Knut Eichhorn-Mulligan, MD, PhD e Ivana K. Kim, MD, Boston
Los nevos coroideos, especialmente los pequeños, son comunes. Las estimaciones de su prevalencia oscilan entre el 5 y el 10 por ciento de la población general. El Blue Mountains Eye Study registró nevos coroideos en el 6,5 por ciento de una población estudiada prospectivamente de australianos de mediana edad en su mayoría.1 Los melanomas coroideos, por otro lado, son afortunadamente una entidad rara, con una incidencia estimada de aproximadamente seis por millón. No obstante, el melanoma coroideo es la neoplasia intraocular primaria más frecuente en adultos, y es importante un diagnóstico rápido y preciso.
Características de los nevos
Histológicamente, los nevos son neoplasias benignas de los melanocitos que residen en las capas externas de la coroides. Suelen aparecer como una lesión plana, de color gris pizarra, debajo de la retina. Sin embargo, los nevos pueden ser completamente no pigmentados hasta en un 10% de los casos.2 Se estima que el riesgo de transformación maligna es bastante bajo.3 No obstante, los nevos tienen el potencial de causar una disfunción visual, especialmente si están situados cerca de la fóvea. Al comprimir la coriocapilar subyacente, los nevos más gruesos pueden obstruir el flujo sanguíneo al EPR y a las capas externas de la retina y provocar la degeneración del EPR y de los fotorreceptores.4 Los nevos se han asociado a defectos del campo visual en un número sorprendentemente elevado de pacientes, aunque si son periféricos, estos déficits pueden no llegar a ser sintomáticos.5,6 Entre las complicaciones más significativas desde el punto de vista visual que se han observado en relación con los nevos benignos se encuentran los desprendimientos serosos del EPR y de la retina y la neovascularización coroidea.4 Una revisión reciente de la función visual en más de 3.400 pacientes con nevos en el Wills Eye Hospital mostró que el riesgo estimado de pérdida de visión a lo largo de 15 años era del 2% en los pacientes con nevos extrafoveales, pero del 26% en los pacientes con nevos subfoveolares.7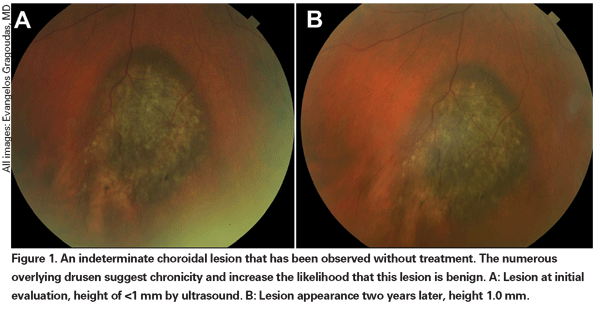
Si los melanomas surgen de los nevos preexistentes, o son en realidad una entidad separada, es algo controvertido. El análisis de ojos enucleados ha demostrado rasgos histológicos característicos de los nevos dentro de los bordes de los melanomas malignos, lo que sugiere que al menos algunos melanomas pueden evolucionar a partir de la transformación maligna dentro de nevos preexistentes.8 No obstante, el riesgo de que un nevo coroideo se convierta en un melanoma se considera generalmente muy bajo. Las estimaciones de las tasas anuales de transformación maligna varían entre una de cada 4.800 y una de cada 8.800.3,9
En general, los nevos coroideos pequeños rara vez se agrandan. En el estudio de las Montañas Azules, de 160 nevos (con un diámetro medio de 1,25 mm), para los que se disponía de al menos cinco años de seguimiento, sólo uno mostró un ligero aumento de diámetro.10 Sin embargo, existen varios informes de nevos coroideos confirmados histológicamente que habían mostrado un agrandamiento progresivo, pero que carecían de características malignas en una revisión cuidadosa.11,12 Además, en un análisis de más de 2.500 ojos seguidos en una consulta de referencia terciaria, Carol Shields, MD, y sus colegas observaron un agrandamiento en el 3 al 4 por ciento de los nevos sin características de transformación maligna.2 Los nevos de esta cohorte basada en la clínica eran significativamente más grandes al inicio que los del estudio Blue Mountains basado en la población, con un promedio de aproximadamente 5 mm de diámetro.

Detección de melanomas pequeños
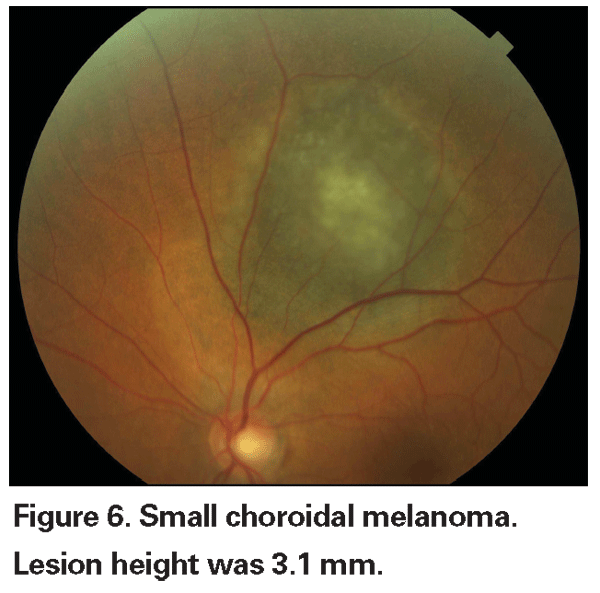
Las lesiones coroideas pigmentadas ligeramente elevadas pueden denominarse lesiones indeterminadas y suponen un reto en cuanto a su diagnóstico y manejo. Dados los riesgos y las limitaciones con respecto a la obtención de la confirmación histológica de la malignidad, los oftalmólogos necesitan confiar en las características clínicas identificadas como predictoras del crecimiento y la metástasis para diferenciar los melanomas pequeños de los tumores melanocíticos coroidales elevados que son probablemente benignos. El Dr. Shields y sus colegas identificaron cinco factores asociados al riesgo de crecimiento de lesiones melanocíticas coroideas pequeñas de menos de 3 mm de grosor a partir de análisis retrospectivos de aproximadamente 1.300 pacientes.13 Estos factores fueron 1) grosor del tumor superior a 2,0 mm; 2) líquido subretiniano; 3) síntomas visuales; 4) pigmento naranja; 5) margen posterior del tumor en contacto con el disco. El crecimiento de la lesión se observó en el 4% de los pacientes sin ninguno de estos factores de riesgo, en el 36% de los que tenían un factor de riesgo y en más del 50% de los que tenían tres o más factores.14 Los factores clínicos asociados a un mayor riesgo de metástasis fueron 1) margen posterior que toca el disco; 2) crecimiento documentado; y 3) mayor grosor del tumor (mayor/igual a 1,1 mm).13 El estudio observacional de pequeños tumores realizado por el Grupo de Estudio Colaborativo de Melanoma Ocular (COMS) identificó factores de riesgo similares asociados con el crecimiento del tumor; a saber, 1) mayor grosor apical del tumor, 2) mayor diámetro basal inicial, 3) presencia de pigmento naranja, 4) ausencia de drusas, y 5) ausencia de cambios en el epitelio pigmentario de la retina adyacente al tumor.15 Estos dos últimos factores confirman la observación clínica de que la presencia de drusas y de alteraciones del pigmento son indicadores de cronicidad y, por lo tanto, es más probable que se observen sobre lesiones latentes y benignas. 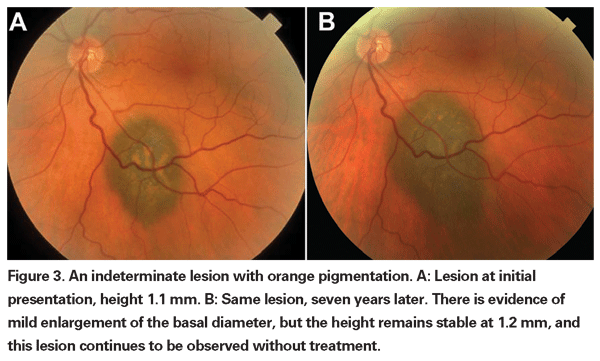
Las características de las imágenes también pueden ser útiles para evaluar el potencial de malignidad. La presencia de una zona tranquila interna en la ultrasonografía B-scan y los puntos calientes en la angiografía con fluoresceína han demostrado ser predictores del crecimiento del tumor.16 También se está explorando el papel de la tomografía de coherencia óptica en la evaluación de las lesiones coroideas. La Dra. Gabriella Espinoza y sus colegas han propuesto que la OCT puede ser valiosa para diferenciar entre el líquido subretiniano activo, en el que la retina que recubre la lesión está elevada pero tiene un aspecto normal, y los cambios crónicos como el adelgazamiento de la retina o los quistes intrarretinianos. En su pequeña serie, encontraron una correlación entre un líquido subretiniano activo en la OCT y el crecimiento tumoral documentado.17
Tratamiento temprano vs. Observación
Cuando la enucleación era la única forma de tratamiento aceptada para el melanoma, se abogaba por la observación hasta el crecimiento documentado de los tumores pequeños que no podían ser diagnosticados definitivamente como melanomas en su presentación inicial. En la actualidad, con la disponibilidad y la eficacia demostrada de las terapias de preservación del globo, se puede argumentar a favor de un tratamiento más temprano de estas lesiones indeterminadas. Los datos de los ensayos COMS revelan que la mortalidad relacionada con el melanoma varía con el tamaño del tumor en el momento del tratamiento. En el caso de los tumores medianos (definidos como tumores de 2,5 a 10 mm de altura apical y hasta 16 mm de diámetro basal mayor), la mortalidad específica del melanoma fue del 10% a los cinco años, y del 18% a los 10 años.18 En el caso de los tumores grandes (los que superan los criterios de tamaño de los tumores medianos en cuanto a altura apical o diámetro basal mayor; o los tumores peripapilares con una altura apical superior a 8 mm), las tasas aumentaron hasta aproximadamente el 27% a los cinco años y el 40% a los 10 años.19 Además, como se ha mencionado anteriormente, se ha demostrado que el crecimiento documentado antes del tratamiento es un factor de riesgo de metástasis. Sin embargo, el crecimiento puede ser un marcador de tumores más agresivos, y no se ha demostrado que tratar estos tumores antes reduzca la mortalidad.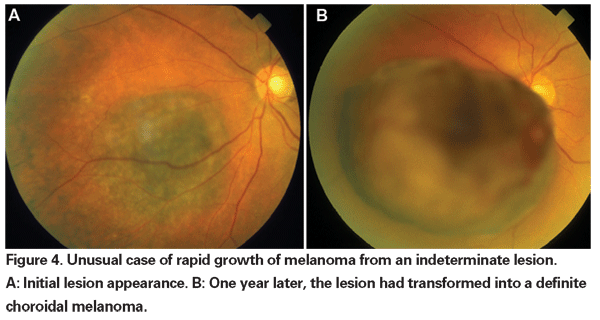
Nuestros métodos actuales de radioterapia permiten un control local eficaz del tumor con conservación del globo, pero la morbilidad visual sigue siendo alta. Por lo tanto, es necesario sopesar el riesgo de mortalidad incurrido por la observación cuidadosa antes del tratamiento de las lesiones indeterminadas contra las consecuencias de la pérdida visual inducida por la terapia. En el estudio observacional de pequeños tumores COMS, se produjeron seis muertes relacionadas con el melanoma en un grupo de 67 pacientes con tumores que fueron tratados después de un período inicial de observación.20 Sólo dos de estas muertes se produjeron en los cinco años posteriores a la inscripción, lo que dio como resultado una tasa de mortalidad específica del melanoma a los cinco años del 3% aproximadamente. Más recientemente, los investigadores del Bascom Palmer Eye Institute informaron de una tasa de mortalidad específica por melanoma a cinco años del 3,9% en un pequeño grupo de pacientes con sospecha de melanoma coroideo observados por crecimiento o desarrollo de pigmento naranja antes del tratamiento con radioterapia en placa.21 Estos estudios sugieren bajas tasas de mortalidad asociadas con el retraso en el tratamiento de lesiones indeterminadas. Además, una pequeña serie retrospectiva no mostró un aumento de la mortalidad específica por melanoma entre los pacientes tratados con prontitud y los observados inicialmente.22 Hasta la fecha, no hay pruebas que demuestren un beneficio de supervivencia por el tratamiento más temprano frente al tardío de los tumores pequeños que no pueden diagnosticarse definitivamente como melanomas. Por lo tanto, no está claro que sacrificar la visión en un mayor número de pacientes con lesiones indeterminadas vaya a salvar definitivamente más vidas.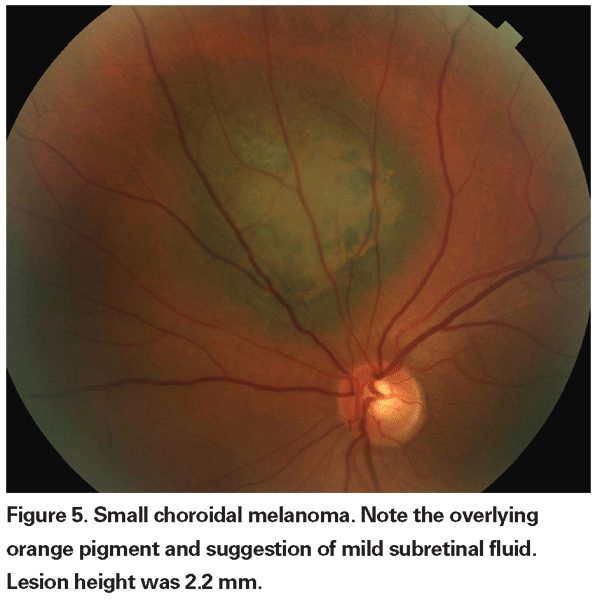
Para resumir, las lesiones pigmentadas coroideas pueden agruparse en tres categorías: 1) lesiones pequeñas y planas que son claramente nevos coroideos; 2) lesiones pequeñas con elevación <2,5 mm que pueden tener pigmento naranja o líquido subretiniano o alguno de los otros factores que hacen sospechar de malignidad: las llamadas lesiones indeterminadas; y 3) tumores coroideos en forma de cúpula o de hongo mayores/igual a 2,5 mm que son claramente melanomas. El tratamiento de las lesiones indeterminadas sigue siendo un área de controversia, y la evaluación y el tratamiento de estas lesiones son realizados por oncólogos oculares. Un ensayo clínico que compare el tratamiento precoz frente al tardío de las lesiones indeterminadas puede no ser factible debido al gran número de pacientes y a la duración del seguimiento necesario para obtener resultados concluyentes. Con los continuos avances en las técnicas de diagnóstico molecular, la mejor esperanza para aumentar la supervivencia de los pacientes con melanoma coroideo reside en el desarrollo de tratamientos eficaces para la enfermedad metastásica y en la búsqueda de biomarcadores que puedan predecir con mayor precisión la transformación maligna.
La Dra. Eichhorn-Mulligan es residente en oftalmología en la Facultad de Medicina de Harvard. El Dr. Kim es profesor asistente en el Departamento de Oftalmología de la Facultad de Medicina de Harvard, Servicio de Retina, Massachusetts Eye and Ear Infirmary.
1. Sumich P, Mitchell P, Wang J. Choroidal nevi in a white population – the Blue Mountains Eye Study. Arch of Ophthalmol 1998;116: 645-650.
2. Shields CL, Furuta M, Mashayekhi A, Berman EL, Zahler JD, Hoberman DM, Dinh DH, Shields JA. Clinical spectrum of choroidal nevi based on age at presentation in 3,422 consecutive eyes. Ophthalmology 2007: Dec 5.
3. Singh AD, Kalyani P, Topham A. Estimación del riesgo de transformación maligna de un nevus coroideo. Ophthalmology 2005;112: 1784-1789.
4. Gonder JR, Augsburger JJ, McCarthy EF, Shields JA. Pérdida visual asociada a los nevos coroideos. Ophthalmology 1982;89:961-965.
5. Tamler E, Maumenee AE. Estudio clínico de los nevos coroideos. Arch Ophthalmol 1959;62:196-202.
6. Flindall RJ, Drance SM. Estudios del campo visual de los melanomas coroideos benignos. Arch Ophthalmol 1969;81:41-44.
7. Shields CL, Furuta M, Mashayekhi A, Berman EL, Zahler JD, Hoberman DM, Dinh DH, Shields JA. Agudeza visual en 3.422 ojos consecutivos con nevus coroideos. Arch Ophthalmol 2007;125:1501-1507.
8. Yanoff M, Zimmerman LE. Histogénesis de los melanomas malignos de la úvea. II. Relación de los nevos uveales con los melanomas malignos. Cancer 1967;20:493-507.
9. Ganley JP, Comstock GW. Nevos benignos y melanomas malignos de la coroides. Am J Ophthalmol 1973;76:19-25.
10. Thiagalingam S, Wang JJ, Mitchell P. Ausencia de cambios en los nevos coroideos a lo largo de 5 años en una población de edad avanzada. Arch Ophthalmol 2004;122:89-93.
11. MacIlwaine WA, Anderson B Jr, Klintworth GK. Agrandamiento de un nevo coroideo histológicamente documentado. Am J Ophthalmol 1979;87:480-486.
12. Elner VM, Flint A, Vine AK. Histopatología del crecimiento documentado en pequeños tumores melanocíticos de coroides. Arch Ophthalmol 2004;122:1876-1878.
13. Shields CL, Shields JA, Kiratli H, De Potter P, Cater JR. Risk factors for growth and metastasis of small choroidal melanocytic lesions. Ophthalmology 1995;102:1351-1361.
14. Shields CL, Cater J, Shields JA, Singh AD, Santos MCM, Carvalho C. Combinación de factores clínicos predictivos del crecimiento de pequeños tumores melanocíticos coroideos. Arch Ophthalmol 2000;118:360-364.
15. El grupo de estudio colaborativo de melanoma ocular. Factores predictivos del crecimiento y tratamiento del melanoma coroideo pequeño. Arch Ophthalmol 1997;115:1537-1544.
16. Butler P, Char DH, Zarbin M, Kroll S. Natural history of indeterminate pigmented choroidal tumors. Ophthalmology 1994;101: 710-716.
17. Espinoza G, Rosenblatt B, Harbour W. Optical coherence tomography in the evaluation of retinal changes associated with suspicious choroidal melanocytic tumors. Am J Ophthalmol 2004;137:90-95.
18. El Grupo de Estudio Colaborativo de Melanoma Ocular. The COMS randomized trial of iodine 125 brachytherapy for choroidal melanoma: V. Twelve-year mortality rates and prognostic factors: COMS report No. 28. Arch Ophthalmol 2006;1684-1693.
19. Hawkins BS, El grupo de estudio del melanoma ocular en colaboración. The Collaborative Ocular Melanoma Study (COMS) randomized trial of pre-enucleation radiation of large choroidal melanoma: IV. Resultados de mortalidad a diez años y factores de pronóstico. COMS report no. 24. Am J Ophthalmol 2004;138:936-951.
20. The Collaborative Ocular Melanoma Study Group. Mortalidad en pacientes con melanoma coroideo pequeño. Arch of Ophthalmol 1997;115:886-893.
21. Sobrin L, Schiffman JC, Markoe AM, Murray TG. Outcomes of iodine 125 plaque radiotherapy after initial observation of suspected small choroidal melanomas. Ophthalmology 2005;112:1777-1783.
22. Augsburger JJ, Vrabec TR. Impact of delayed treatment in growing posterior uveal melanomas. Arch Ophthalmol 1993;111:1382-6.