はじめに
イオン結合は原子間で価電子を完全に移動させることです。 これは、2つの反対方向に帯電したイオンを生成する化学結合の一種である。 イオン結合では、金属は電子を失って正電荷の陽イオンになり、非金属はそれらの電子を受け入れて負電荷の陰イオンになります。
イオン結合が見られるのは、金属が最外周軌道にほとんど電子を持っていないためです。 これらの電子を失うことで、これらの金属は希ガス配置を達成し、八重項則を満たすことができます。 同様に、価電子帯に8個近い電子を持つ非金属は、電子を容易に受け入れて希ガス配置を達成する傾向がある。 イオン結合の場合、1個以上の電子を供与または受容することでオクテット則を満たすことができる。 アニオンとカチオンの電荷は、供与または受容された電子の数に対応する。
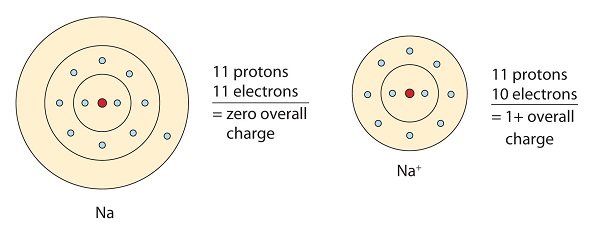
このナトリウム分子は、八重項配置を達成するために、その価電子軌道の孤立電子を提供します。
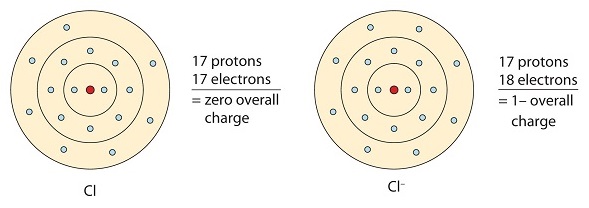
この塩素原子は八重配置を達成するために電子を 1 つ受け取り、負に帯電した陰イオンが生成されました。
金属のイオン化エネルギーと非金属の電子親和力を含むイオン結合プロセスの予測総合エネルギーは通常正であり、この反応が吸熱的で不利であることを示します。 しかし、この反応は粒子間の静電引力により非常に有利な反応となる。 理想的な原子間距離では、これらの粒子間の引力は反応を促進するのに十分なエネルギーを放出する。 ほとんどのイオン性化合物は極性溶媒中で解離する傾向がありますが、これはイオン性化合物が極性であることが多いからです。
例(˶‾᷄ -̫ ‾᷅˵ )。
.jpg?revision=2)
この例では、ナトリウム原子が塩素原子に1価の電子を供与していることがわかります。 これにより、ナトリウムカチオンと塩素アニオンが生成されます。
.jpg?revision=2)
この例では、マグネシウム原子がその価電子を両方とも塩素原子に供与しています。 塩素原子は1個につき1個の電子しか受け取れないので、マグネシウムから提供された2個の電子を受け取るには、塩素原子が2個必要です。 Notice that the net charge of the compound is 0.