不飽和度の計算
不飽和度(DoU)は、二重結合当量としても知られています。 分子式が与えられている場合は、この式に数値をプラグインする。
- (Cache) is the number of carbons
- (Nache) is the number of nitrogens
- (Xache) is the number of halogens (F, Cl.),
- H
前に述べたように、飽和分子には単結合だけがあり、環はない。 別の解釈として、飽和分子は非環状アルカンになりうる最大数の水素原子を持つということです。 したがって、水素の数は2C+2で表すことができ、これがアルカンの一般的な分子表現である。 例えば、分子式C3H4の場合、化合物が飽和するために実際に必要な水素の数は8個である。 この化合物が完全に飽和するためには、さらに4つの水素が必要です(水素の予想数-水素の観察数=8-4=4)。 不飽和度は2、つまり分子が飽和に分類されるために必要な水素の数の半分に相当します。 ハロゲン(X)は化合物中の水素を置き換えるので、式はXの数を差し引いたものになります。 例えば、クロロエタン(C2H5Cl)では、エタン(C2H6)に比べて水素が1つ少なくなる。
化合物が飽和であるためには、窒素があると分子内の水素が1つ多くなる。 そこで、窒素の数(N)を足すのです。 これはC3H8と比較してC3H9Nで見ることができます。 酸素と硫黄は飽和に影響しないので、式には含めない。 As seen in alcohols, the same number of hydrogens in ethanol, C2H5OH, matches the number of hydrogens in ethane, C2H6.
The following chart illustrates the possible combinations of the number of double bond(s), triple bond(s), and/or ring(s) for a given degree of unsaturation. Each row corresponds to a different combination.
- One degree of unsaturation is equivalent to 1 ring or 1 double bond (1 \( \pi \) bond).
- Two degrees of unsaturation is equivalent to 2 double bonds, 1 ring and 1 double bond, 2 rings, or 1 triple bond (2 \( \pi \) bonds).
|
DoU
|
Possible combinations of rings/ bonds
|
||
|---|---|---|---|
|
|
# of rings
|
# of double bonds
|
# of triple bonds
|
|
1
|
1
|
0
|
0
|
|
|
0
|
1
|
0
|
|
2
|
2
|
0
|
0
|
|
|
0
|
2
|
0
|
|
|
0
|
0
|
1
|
|
|
1
|
1
|
0
|
| 3 | 3 | 0 | 0 |
| 2 | 1 | 0 | |
| 1 | 2 | 0 | |
| 0 | 1 | 1 | |
| 0 | 3 | 0 | |
| 1 | 0 | 1 | |
Remember, 不飽和度は、二重結合、三重結合、環の総和を与えるだけです。 たとえば、不飽和度 3 は、3 つのリング、2 つのリング + 1 二重結合、1 つのリング + 2 二重結合、1 つのリング + 1 三重結合、1 つの二重結合 + 1 三重結合、または 3 つの二重結合を含むことができます
例:: ベンゼン
ベンゼンの不飽和度はどのくらいか
解決方法
ベンゼンの分子式はC6H6です。 したがって、
DoU=4 で、C=6, N=0, X=0, H=6 となります。 1つのDoBは1つのリングまたは1つの二重結合に等しいことができます。
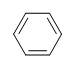
しかしながら、分子式 C6H6 が与えられたとき、ベンゼンは多くの可能な構造(異性体)のひとつでしかないのです。 以下の構造は、すべてDoBが4で、ベンゼンと同じ分子式を持っています。