形式電荷
有機分子にも正または負の電荷が付随していることがあります。 化学反応では、反応物、中間体、および/または生成物が電荷を持つことが一般的です。 中性結合と荷電結合のパターンを認識し、区別することは、反応機構を学ぶ上で有用である。 メタノールCH3OHのルイス構造を考えてみましょう(メタノールは、1920年代の禁酒法時代に悪徳密造業者が時々販売しており、飲んだ人がしばしば失明する原因となったいわゆる「木アルコール」です)。

分子アニオンと分子カチオンは、それぞれ -1 と +1 の全体電荷を持っています。 しかし、もっと具体的に言うと、各分子イオンについて、炭素原子や水素原子ではなく、酸素原子に特別な電荷があることを示すこともできます。
分子のさまざまな原子の形式電荷を把握するのは簡単なプロセスで、単に価電子を加算すればよいのです。
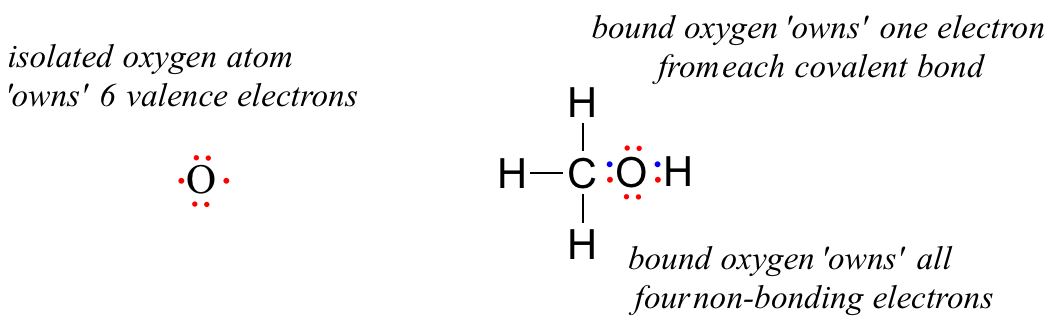
結合していない酸素原子の価電子数は6個ですが、メタノール分子の一部として結合している場合、酸素原子は8個の価電子に囲まれています。4個の非結合電子(2個の「ローンペア」)と2個の共有結合(炭素と水素の結合)にそれぞれ1個の電子が含まれています。 形式的な電荷の慣習では、酸素は4つの非結合電子をすべて「所有」していると言います。 しかし、共有結合は原子間の電子の共有を伴うので、酸素は2つの共有結合からそれぞれ1つの電子しか「所有」していません。 したがって、メタノール中の酸素原子は、2 + 2 + (1/2 x 4) = 6個の価電子を所有していることになります。
The formal charge on an atom is calculated as the number of valence electrons owned by the isolated atom minus the number of valence electrons owned by the bound atom in the molecule:
Determining formal charge on an atom
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of valence electrons owned by the bound atom)
or . . .
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of non-bonding electrons on the bound atom)
– ( ½ the number of bonding electrons on the bound atom)
Using this formula for the oxygen atom of methanol, we have:
formal charge on oxygen =
(6 valence electrons on isolated atom)
– (4 non-bonding electrons)
– (½ x 4 bonding electrons)
= 6 – 4 – 2 = 0. Thus, oxygen in methanol has a formal charge of zero (in other words, it has no formal charge).
How about the carbon atom in methanol? An isolated carbon owns 4 valence electrons. The bound carbon in methanol owns (½ x 8) = 4 valence electrons:
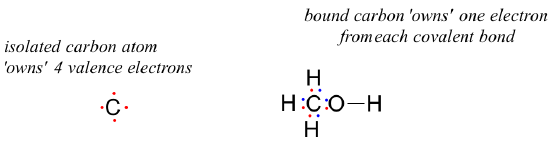
formal charge on carbon =
(4 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 8 bonding electrons)
= 4 – 0 – 4 = 0. So the formal charge on carbon is zero.
For each of the hydrogens in methanol, we also get a formal charge of zero:
formal charge on hydrogen =
(1 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 2 bonding electrons)
= 1 – 0 – 1 = 0
Now, let’s look at the cationic form of methanol, CH3OH2+. The bonding picture has not changed for carbon or for any of the hydrogen atoms, so we will focus on the oxygen atom.
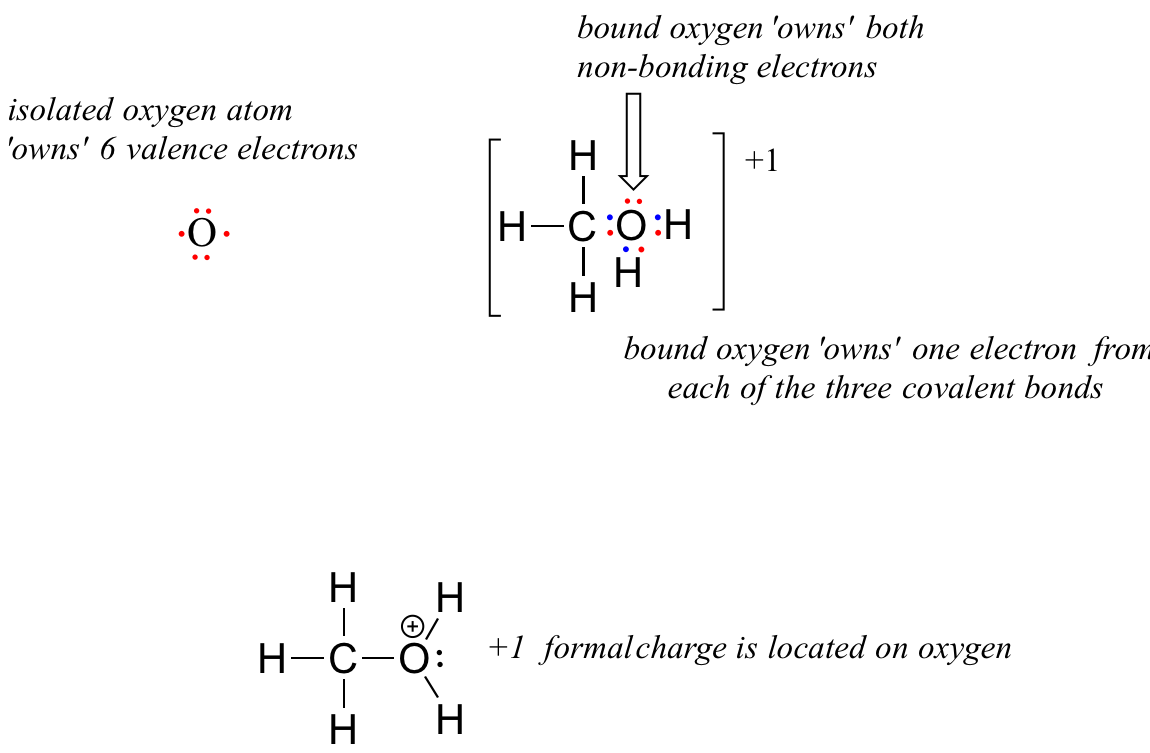
The oxygen owns 2 non-bonding electrons and 3 bonding elections, so the formal charge calculations becomes:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (2 non-bonding electrons)
– (½ x 6 bonding electrons)
= 6 – 2 – 3 = 1. A formal charge of +1 is located on the oxygen atom.
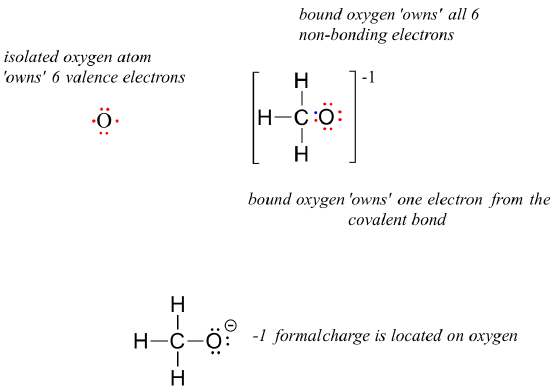
For methoxide, the anionic form of methanol, the calculation for the oxygen atom is:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (6 non-bonding electrons)
– (½ x 2 bonding electrons)
= 6 – 6 – 1 = -1. A formal charge of -1 is located on the oxygen atom.
A very important rule to keep in mind is that the sum of the formal charges on all atoms of a molecule must equal the net charge on the whole molecule.
有機分子の構造を描くときは、電荷の位置を明確にしながら、ゼロでないすべての形式電荷を示すことが非常に重要です。 ゼロ以外の形式電荷がない構造は正しく描かれておらず、おそらく試験でそのようにマークされるでしょう!
この時点で、一般化学で学んだことを思い返すと、おそらく「双極子についてはどうですか? O-H 結合の酸素原子は、電気陰性度が高いので、水素よりも電子密度を「所有」していないのでしょうか? これは全くそのとおりで、結合双極子の概念については後ほど説明します。 しかし、形式電荷を計算する目的では、結合双極子は重要ではありません。たとえそれが化学の現実を正確に反映していなくても、結合中の2つの電子は常に等しく共有されていると考えるからです。 形式電荷はあくまで形式であり、有機化合物やイオンの構造を描くためのルイスシステムに結びついた電子の帳簿管理法である。
最後に、構造上の正味の電荷がゼロだからといって、正味の電荷を持つ原子が存在しないかのように考えないようにしてください。 アミノ酸のような双性イオンには、異なる原子に正と負の両方の形式電荷があります。

グリシンの純電荷がゼロであっても、正と負の形式電荷の位置を示すことが必要です。
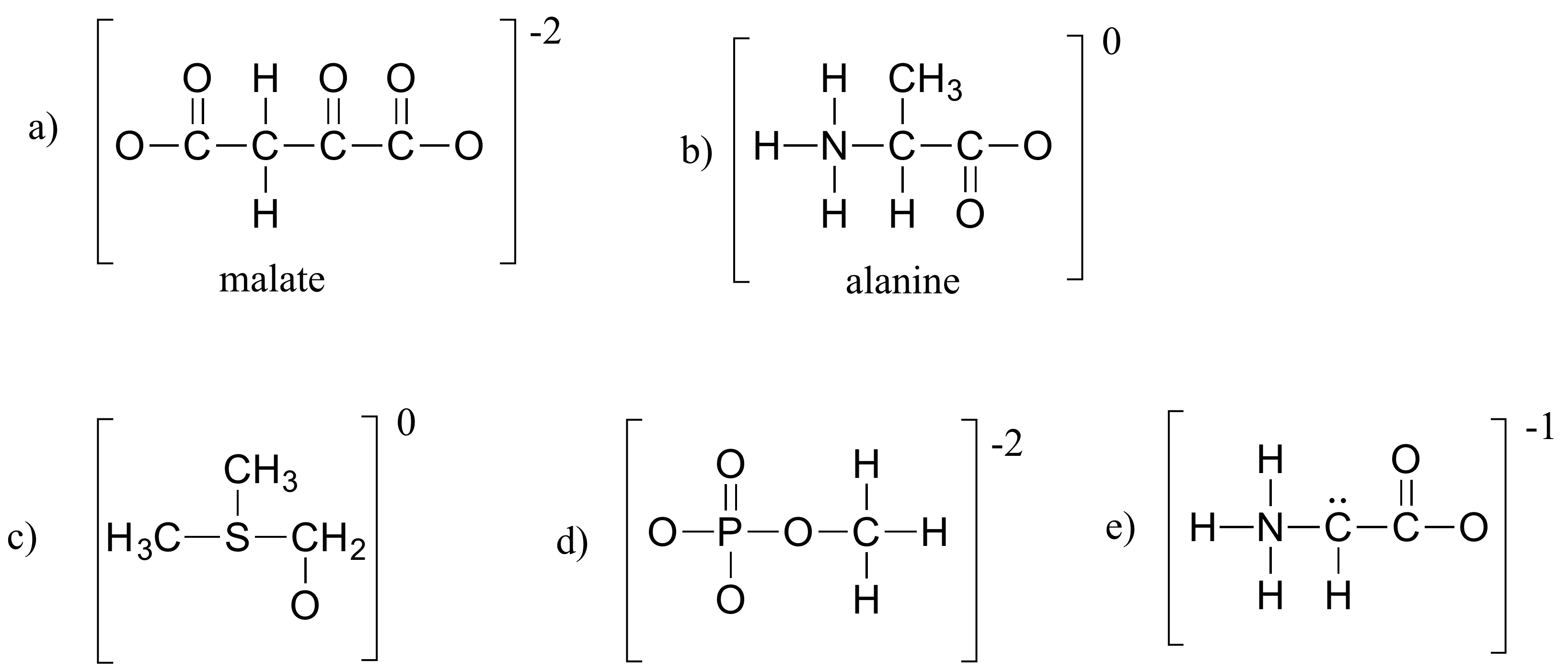
演習 1.4
以下の構造で、不足しているすべての孤立ペア電子と形式電荷を埋めましょう。 すべての原子が完全な電子の価電子帯を持っていると仮定してください。
練習問題の解答

