MO theory and conjugated pi bonds
有機分子の結合を理解するのに MO 理論を使用する利点は、π結合について考えるとより明白になります。 まず、エテンのπ結合をMO理論の立場から考えてみましょう(この例では、分子内のs結合は無視し、π結合だけを考えます)。 まず、2つの原子軌道から始めます。各炭素のハイブリッドされていない2p軌道が1つずつあります。 それぞれ1個の電子を含んでいる。 MO 理論では、2 つの原子が数学的に結合して、2 つのπ分子軌道、1 つは低エネルギーのπ結合軌道、もう 1 つは高エネルギーのπ*反結合軌道を形成します
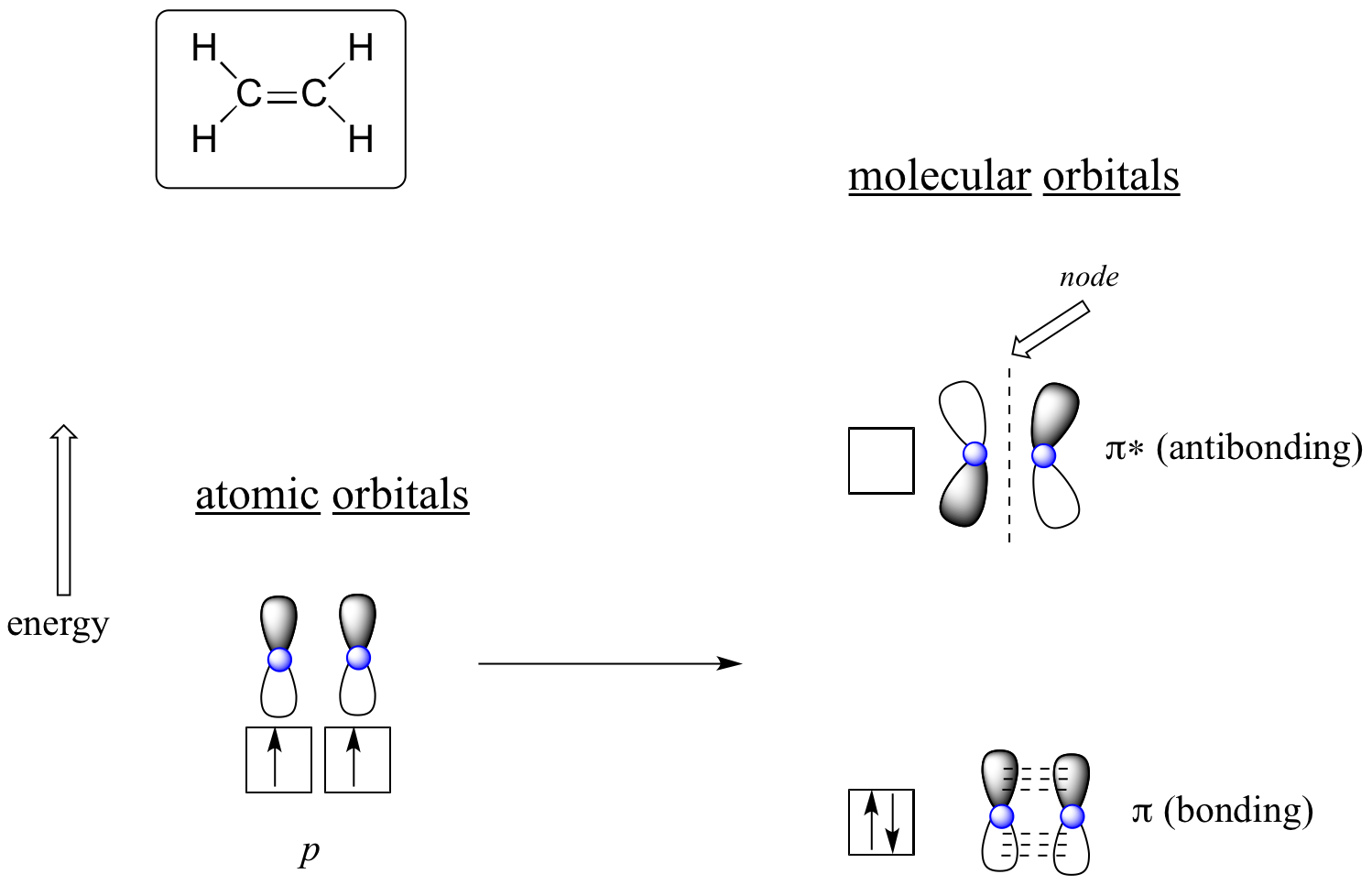
エテン (エチレン) の分子軌道
結合π軌道では、p軌道の影付きの2つのローブは、影なしの2つのローブと同様に、互いに建設的に作用します (任意の影付きの選択は、軌道を記述する数学波動のための数学 (+) と (-) 記号を表すことを覚えておいてください)。
より高エネルギーの反結合 pi* 軌道では、1 つの p 軌道の影のついたローブが 2 番目の p 軌道の影のないローブと破壊的に相互作用し、2 つの核の間にノードが生じ、炭素核の間で全体的に反発し合います。
再び「積み上げ」の原理を使用して、2つの電子をより低いエネルギーで結合するπ分子軌道に配置します。
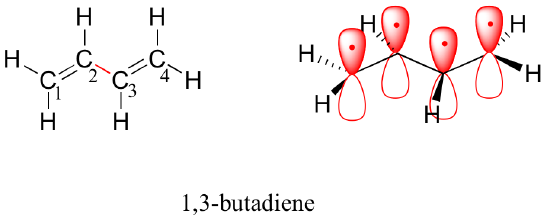
次に、1,3-ブタジエン分子を考えてみましょう。

しかし実験的には、C2-C3結合の回転に大きな障壁があり、分子全体が平面であることが確認されました。
分子軌道理論は、非局在化π結合の概念でこれらの観測を説明します。
分子軌道理論は、非局在化π結合という概念でこの観測結果を説明します。この図では、4つの2p原子軌道が数学的に結合して、エネルギーの増加する4つのπ分子軌道を形成しています。

最もエネルギーの低い分子軌道である pi1 には、建設的な相互作用とゼロノードのみが存在します。 エネルギーが高くても、孤立した p 軌道より低い pi2 軌道は、ノードが 1 つありますが、建設的な相互作用が 2 つあります – したがって、全体として結合軌道であることに変わりありません。 2 つの反結合軌道を見ると、π3* には 2 つのノードと 1 つの構成的相互作用があり、π4* には 3 つのノードと 0 つの構成的相互作用があります。
アウフバウ原理により、孤立 2pz 原子軌道からの 4 つの電子は結合 pi1 と pi2 MO に配置されます。 pi1 は C2 と C3 の間の構成的相互作用を含むので、1,3-ブタジエン分子では、これら 2 つの炭素の間にある程度の pi 結合相互作用があり、これが分子の長さが短く、回転に対する障壁となる理由となっています。 1,3-ブタジエンの価電子結合図では、2つのπ結合は互いに孤立しており、π電子のペアはそれぞれ自分のπ結合に「はまって」いるように見える。
空間充填図
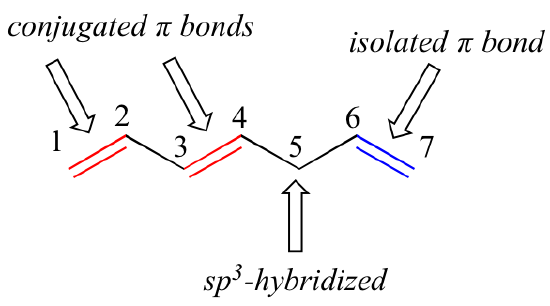
1,3-butadiene は共役π結合のシステムの最も単純な例です。 共役とみなすには、2つ以上のπ結合が1つの単結合で隔てられていなければなりません。言い換えれば、sp3混成炭素が介在することはできませんが、これは平行π軌道の重複系を壊してしまうからです。
心に留めておくべき非常に重要な概念は、共役に関連した固有の熱力学的安定性があることです。 この安定性は、2つの異なるジエンの水素化熱を比較することで、実験的に測定することができます。 (水素化反応とは、第15章で詳しく説明する反応の一種で、基本的にはp結合に水素分子(2個のプロトンと2個の電子)を付加する過程である)。 1,3-ペンタジエンの2つの共役二重結合を「水素化」してペンタンを生成すると、生成したペンタン1モルあたり約225kJが放出される。
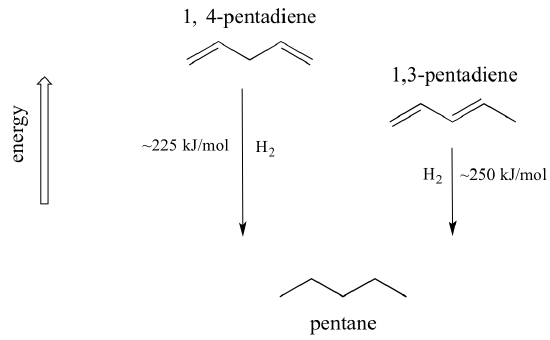
共役ジエンはエネルギーが低い、言い換えれば、より安定しています。
共役πシステムは、炭素だけでなく、酸素や窒素の原子を含むことができます。

第4章では、なぜ共役π結合の拡張システムを含む有機分子がしばしば独特の色を持つかの説明に、MO理論が非常に役に立つことを見ていきます。
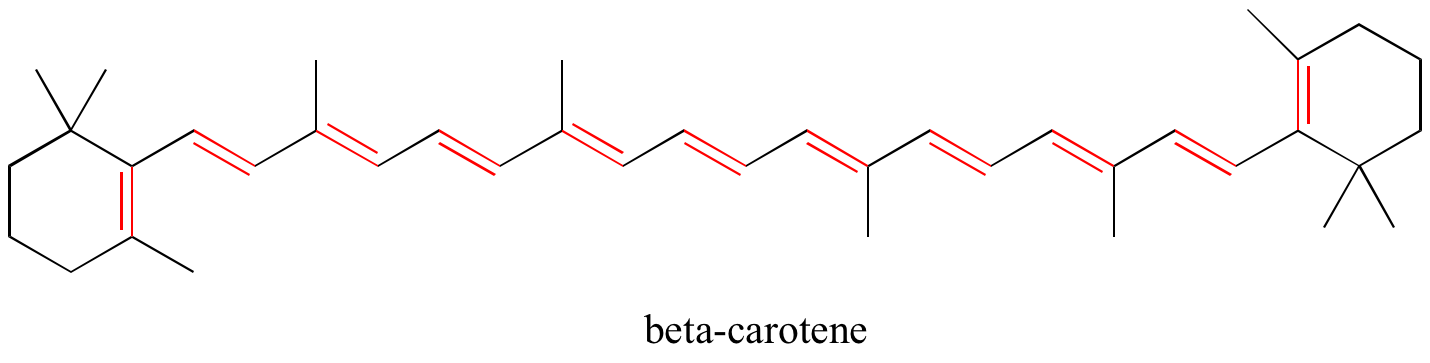
練習問題です。 以下の構造で、すべての共役二重結合と孤立二重結合を特定せよ。 それぞれの共役π系について、重なっているπ軌道の数と、その中で共有されているπ電子の数を明記せよ。
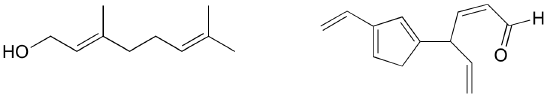
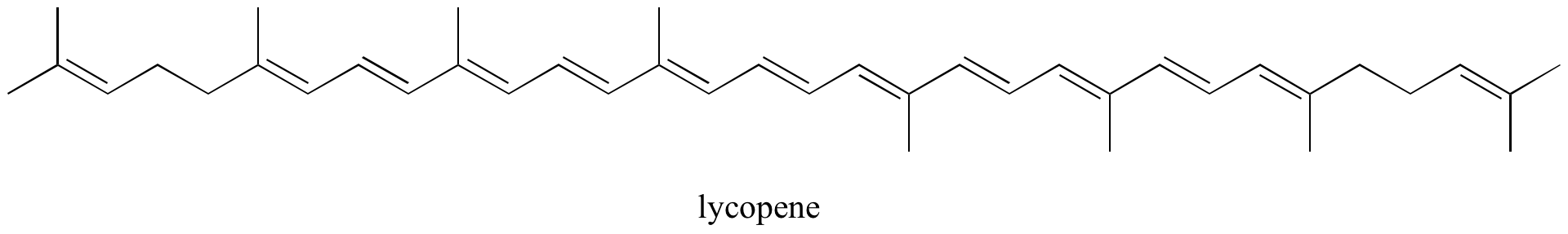
演習を行います。 トマトの赤色化合物であるリコピンの孤立π結合と共役π結合を全て特定せよ。 共役π系に含まれるπ電子の数はいくつでしょう?
演習問題の解答
芳香族 – 究極の共役系
分子軌道理論は、ベンゼンなどの芳香族化合物のユニークな性質を説明するのに特に役立ちます:
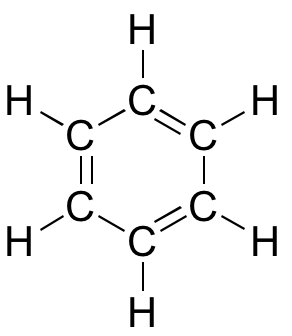
ベンゼンの 3 次元インタラクティブモデル
ベンゼンは 3 つの二重結合と 3 つの単結合で描かれることが多いですが、実際にはすべての炭素-炭素結合はまったく同じ長さ (138 pm) です。 また、ベンゼンのπ結合は、単独でも共役でも、「普通の」π結合より反応性が著しく低い。 ベンゼンの構造上の何かが、そのπ結合の配置を特に安定なものにしているのである。 この「何か」には名前があり、「芳香族性」と呼ばれています。
ベンゼンのπ結合をこれほど安定にしている「芳香族性」とは、いったい何なのでしょうか。 その答えは、ベンゼンが環状分子で、すべての環原子がsp2ハイブリッド化されていることにある。 このため、π電子は環の上下に広がる分子軌道に非局在化することができる。 もちろん、そのためには環が平面でなければならず、そうでなければp軌道がうまく重なり合わない。
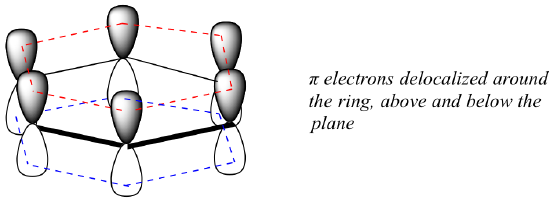
単結合と二重結合を交互に持つすべての環状分子に、これと同じ芳香族の安定性があるのでしょうか。 答えは、実は「ノー」である。
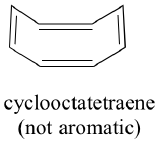
明らかに、芳香族であるためにはもっと何かが必要で、これは分子軌道理論で最もよく説明することができるのです。
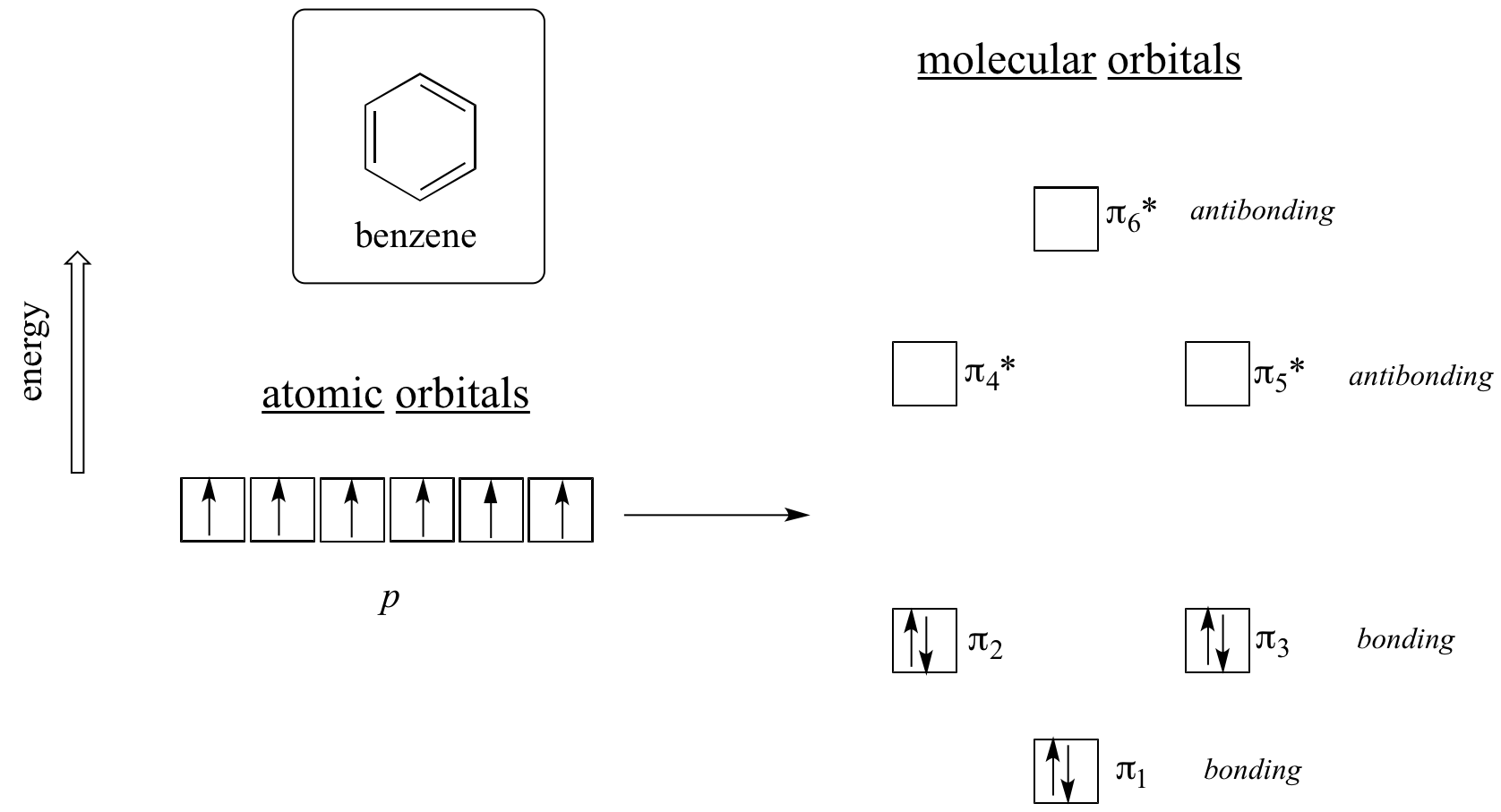
量子力学計算では、ベンゼンの6つのπ分子軌道は、6つの原子p軌道から作られ、4つの別々のエネルギーレベルを占めていることが分かっています。 pi1 と pi6* は固有のエネルギー準位を持ち、pi2 – pi3 と pi4* – pi5* のペアは縮退しており、同じエネルギー準位にあることを意味します。 アウフバウの原理でこれらの軌道をベンゼンの6個のπ電子で埋めてみると、結合軌道は完全に埋まり、反結合軌道は空になることがわかります。 このことは、ベンゼンが特別に安定であることを示す良い手がかりとなります。結合軌道が完全であるということは、安定な希ガスであるヘリウム、ネオン、アルゴンの原子軌道にある電子の「完全殻」に多くの点で似ているからです。
さて、芳香族ではないことがすでに分かっているシクロオクタテトラエンについて、同じことをしてみましょう。
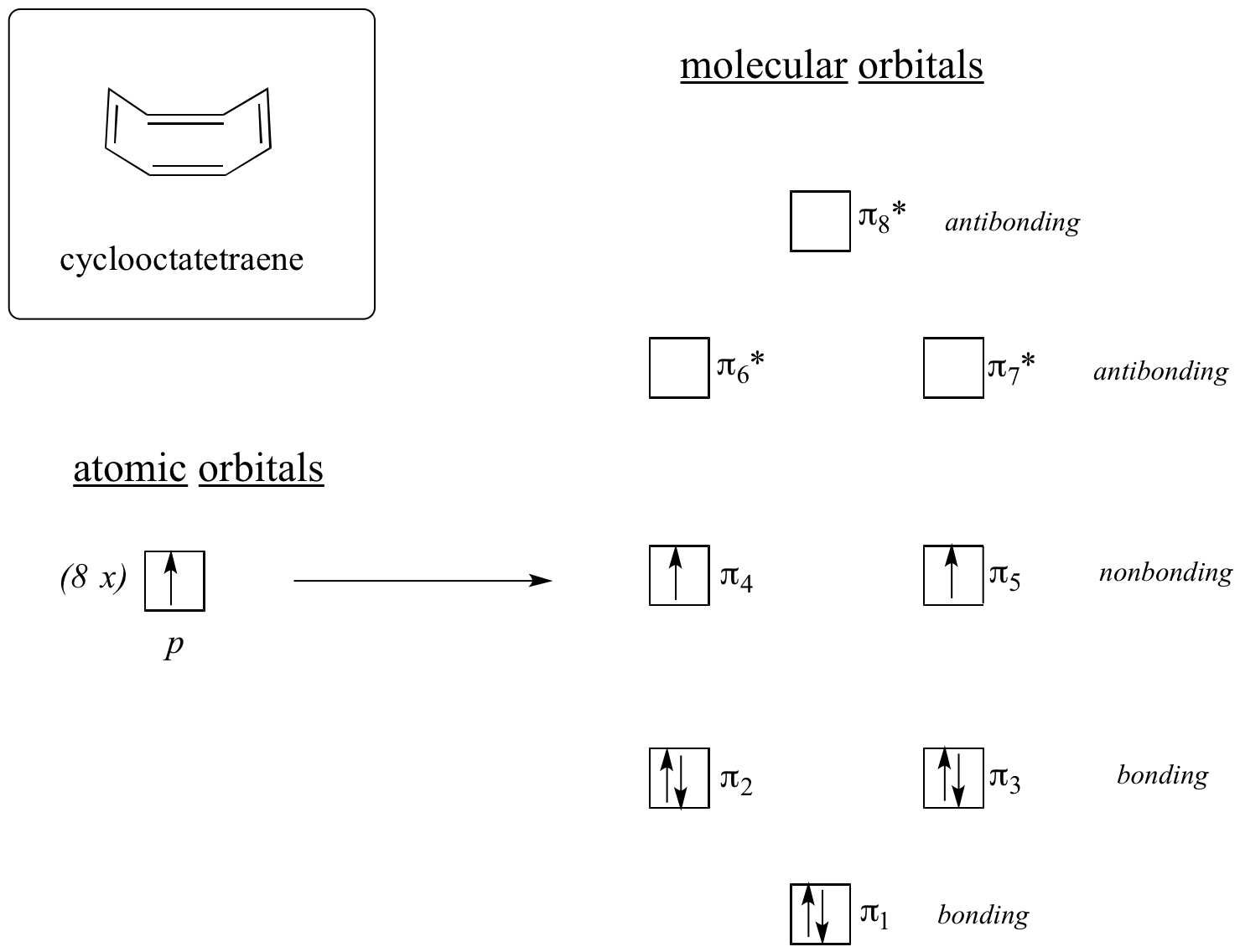
分子軌道計算の結果は、最低および最高エネルギーの MO (pi1 と pi8*) は固有のエネルギー準位を持ち、残りの 6 つは縮退ペアを形成することを物語っています。 pi4とpi5は孤立した2pz原子軌道と同じエネルギー準位にあることに注意してください。したがって、これらは結合でも反結合でもなく、むしろ非結合MOと呼ばれます。 分子内の8個のπ電子で軌道を埋め尽くすと、最後の2個の電子は対になっておらず、縮退した2つの非結合軌道に入ることがわかります。 結合軌道が完全に満たされていないため、この分子は芳香族ではありません。
今のところ、重要な学習目標は、共役π結合系を認識し、ベンゼンが芳香族性と呼ばれる特性を示す例外的な安定性を持っていることを理解することです。 芳香族性と芳香族化合物の化学は比較的複雑であり、このテキストの次の章でさらに詳しく説明します。
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)
このテキストは、有機化合物の化学的性質について説明します。