Electronegativity and Bond Polarity
共有結合を電子の共有と定義しましたが、共有結合中の電子は結合した2つの原子で常に等しく共有されているわけではありません。 H2のように同じ元素の原子同士でない限り、図中のHClのように、結合中の電子をもう一方の原子よりも強く引きつける原子が必ず存在するのです。 電子の分配が等しい共有結合(図)を非極性共有結合と呼びます。 また、図のように電子の分配が不均等な共有結合を極性共有結合と呼びます。

極性結合では電子密度の分布が不均一になります。 電子をより多く引き寄せる原子の周りでより大きくなる。 例えば、塩化水素分子のH-Cl結合の電子は、水素原子の近くよりも塩素原子の近くでより多くの時間を過ごします。
このように電子密度のバランスが崩れると、結合の片側(Cl)に部分的に負の電荷(δ-とする)、もう片側(H)に部分的に正の電荷(δ+とする)が蓄積されることになります。 これは図㊧のようになります。 極性共有結合で電荷が分離すると、図中の矢印で示したような電気双極子(2極)が発生します。
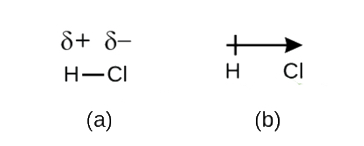
Figure \(\PageIndex{2}).Figure ㊦はその様子を示しています。 (a) HとClの間の結合電子対の不均等な共有により、H原子には部分的に正の電荷が、Clには部分的に負の電荷が生じる。 記号δ+とδ-はH-Cl結合の極性を示す。 (b)双極子は矢印の先端に十字を付けて表した。 十字はδ+端の近く、矢じりはδ-と一致する。
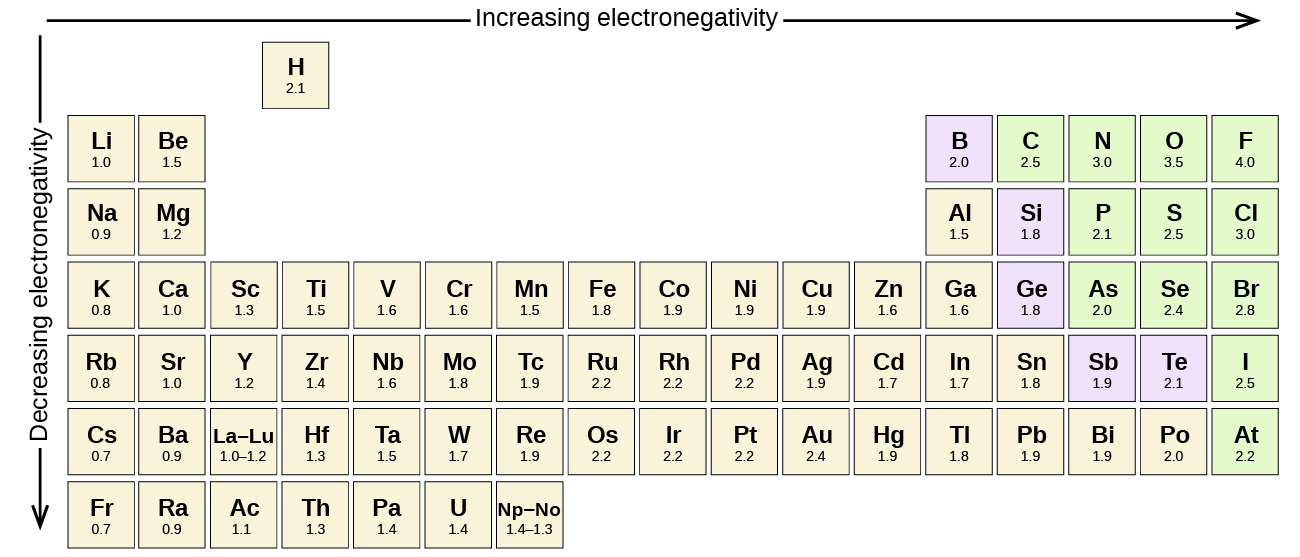
異なる元素の原子間の共有結合はすべて極性結合であるが、極性の程度は大きく変化している。 異なる元素間の結合でも極性が小さいものもあれば、強い極性を持つものもあります。 イオン結合は究極の極性結合であり、電子を共有するのではなく、移動させる結合といえます。 化学者は、共有結合の極性を判断するために、電気陰性度を用いている。 電気陰性度の評価には、さまざまな数値尺度がある。 図に示すのは、最もポピュラーなポーリングスケールです。
Looking Closer: ライナス・ポーリング
おそらく20世紀で最も影響力のある化学者であるライナス・ポーリング(1901-94)は、個人で(つまり共有せずに)2つのノーベル賞を受賞した唯一の人物です。 1930年代、ポーリングは新しい数学的理論を駆使して、化学結合の基本原理をいくつか明らかにした。
1935年までには、ポーリングの関心は生体分子に移り、タンパク質の構造に関する研究により、1954年にノーベル化学賞を受賞しています。 (
1935年には、ポーリングの関心は生体分子へと移り、タンパク質の構造に関する研究で1954年にノーベル化学賞を受賞しました(1953年にジェームズ・ワトソンとジェームズ・クリックがDNAの二重らせん構造の発見を発表したとき、彼はその発見に大きく近づいたのです)。

ライナス・ポーリングは20世紀で最も影響力のある化学者の一人です。
晩年、ポーリングは大量のビタミンCが風邪などの病気を防ぐと確信するようになりました。
ポーリングは晩年、ビタミンCの大量摂取が風邪などの病気を防ぐと確信するようになりました。ほとんどの臨床研究では関連性を示すことができませんでしたが、ポーリングは毎日大量に摂取し続けました。
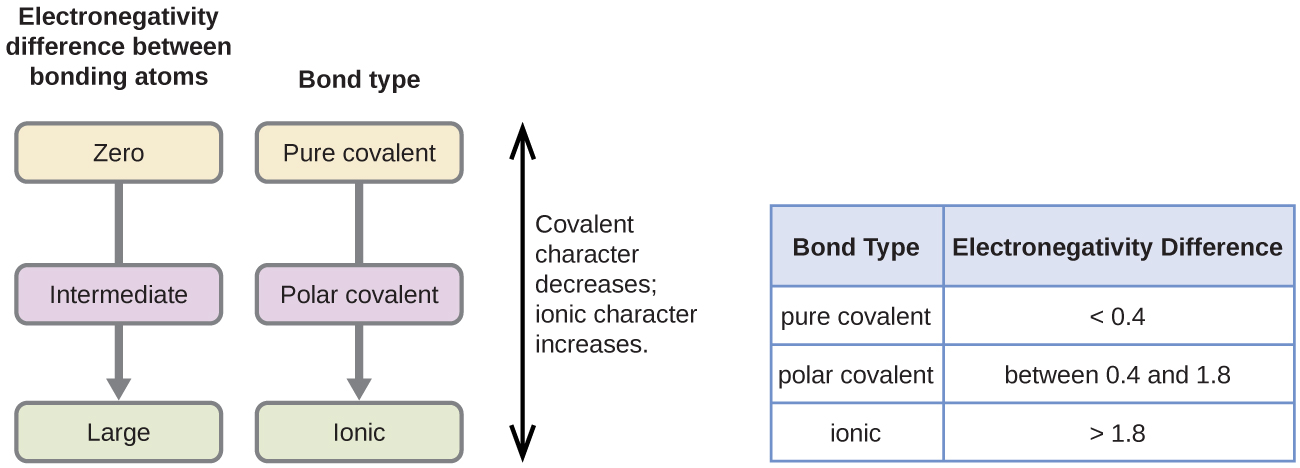
共有結合の極性は、結合を作る2つの原子の電気陰性度の差を決定することによって判断することができます。 電気陰性度の差が大きければ大きいほど、結合における電子共有の不均衡が大きくなります。 厳密なルールはありませんが、一般的には電気陰性度の差が約0.4より小さい場合は非極性結合、0.4より大きい場合は極性結合とみなされます。 電気陰性度の差が十分大きい場合(一般に約1.8以上)、生成する化合物は共有結合ではなくイオン結合とみなされる。
例題 Ⓐ原子間の電気陰性度の差と極性(または結合様式)を記述しなさい。
- C と H
- H と H
- Na と Cl
- O と H
解答
- Carbon は 2.5, hydrogen は 2.1 であり、電気陰性度の差があることがわかる。 その差は0.4であり、むしろ小さい。 したがって、C-H 結合は非極性とみなされます。
- 両方の水素原子の電気陰性度は同じ値 2.1 です。
- ナトリウムの電気陰性度は 0.9 であり、塩素の電気陰性度は 3.0 です。
- 水素が 2.1 で、酸素が 3.5 なので、電気陰性度の差は 1.4 です。 非常に極性の高い結合であることが予想されます。 The sharing of electrons between O and H is unequal with the electrons more strongly drawn towards O.
Exercise \(\PageIndex{1}\)
Describe the electronegativity (EN) difference between each pair of atoms and the resulting polarity (or bond type).
- C and O
- K and Br
- N and N
- Cs and F
Answer a:
The EN difference is 1.0 , hence polar. The sharing of electrons between C and O is unequal with the electrons more strongly drawn towards O.
Answer b:
The EN difference is greater than 1.8, hence ionic.
Answer c:
Identical atoms have zero EN difference, hence nonpolar.
Answer d:
The EN difference is greater than 1.8, hence ionic.