Dosage Form: powder for oral suspension
Medically reviewed by Drugs.com. Last updated on April 1, 2019.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
- INDICATIONS & USAGE
- Respiratory Tract Infections
- Otitis Media
- 皮膚・皮膚構造感染症
- 骨感染症
- 尿路感染症
- 投与量 & ADMINISTRATION
- 成人および15歳以上の小児患者
- 小児患者(1歳以上)
- 腎障害のある15歳以上の成人および小児患者における用法・用量調節
- 剤形 & 強さ
- 禁忌
- 警告と注意
- 過敏性反応
- Clostridium difficile関連下痢
- 直接クームス試験血清転換
- 痙攣の可能性
- プロトロンビン時間の延長
- 薬剤耐性菌の発生
- 副作用
- 臨床試験の経験
- 薬物相互作用
- メトホルミン
- プロベネシド
- 臨床検査・診断との相互作用
- 特定集団における使用
- 妊娠
- 授乳婦
- 小児用
- 老人用
- 腎障害
- 過量投与
- セファレキシン懸濁液の説明
- セファレキシン懸濁液-臨床薬理
- 作用機序
- 薬物動態
- 微生物学
- Nonclinical Toxicology
- Carcinogenesis & Mutagenesis & Impairment Of Fertility
- How Supplied/Storage and Handling
- 患者相談情報
- PACKAGE LABEL.PRINCIPAL DISPLAY PANEL
- Frequently asked questions
- More about cephalexin
- Consumer resources
- Professional resources
- Related treatment guides
INDICATIONS & USAGE
Respiratory Tract Infections
Cephalexin is indicated for the treatment of respiratory tract infections caused by susceptible isolates of Streptococcus pneumoniae and Streptococcus pyogenes.
Otitis Media
Cephalexin is indicated for the treatment of otitis media caused by susceptible isolates of Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus, Streptococcus pyogenes, and Moraxella catarrhalis.
皮膚・皮膚構造感染症
セファレキシンは、以下のグラム陽性菌の感受性分離物によって引き起こされる皮膚・皮膚構造感染症の治療に適応されます。
骨感染症
セファレキシンは、感受性分離された黄色ブドウ球菌およびプロテウス・ミラビリスによって引き起こされる骨感染症の治療が適応となります。
尿路感染症
セファレキシンは、大腸菌、プロテウス・ミラビリス、クレブシエラ・ニューモニエの感受性分離菌による急性前立腺炎を含む尿路感染症の治療が適応とされています。
使用方法
薬剤耐性菌の発生を抑え、セファレキシンや他の抗菌薬の効果を維持するために、セファレキシンは感受性菌が原因であることが証明されているか強く疑われている感染症の治療にのみ使用する必要があります。 培養および感受性に関する情報が入手可能な場合は,抗菌薬療法の選択または変更に際して,その情報を考慮する必要がある。
投与量 & ADMINISTRATION
成人および15歳以上の小児患者
セファレキシンとして通常250mgを6時間ごとに経口投与するが、500mgを12時間ごとに投与することもできる。
より重症の感染症には、1日4gまで、2~4回に分けて大量に投与する必要があります。
小児患者(1歳以上)
小児患者に対するセファレキシン経口剤の推奨1日総量は25~50mg/kgで、7~14日間等量に分けて投与しています。 なお,β溶血性レンサ球菌感染症では,少なくとも10日間投与することが望ましい。 In severe infections, a total daily dose of 50 to 100 mg/kg may be administered in equally divided doses.
For the treatment of otitis media, the recommended daily dose is 75 to 100 mg/kg given in equally divided doses.
| Weight 10 kg (22 lb) 20 kg (44 lb) 40 kg (88 lb) |
Cephalexin Suspension 125mg/5mL ½ to 1 tsp q.i.d. 1 to 2 tsp q.i.d. 2 to 4 tsp q.i.d. |
250mg/5mL ¼ to ½ tsp q.i.d. ½ to 1 tsp q.i.d. 1 to 2 tsp q.i.d. |
| Weight 10 kg (22 lb) 20 kg (44 lb) 40 kg (88 lb) |
125mg/5mL 1 to 2 tsp b.i.d. 2 to 4 tsp b.i.d. 4 to 8 tsp b.i.d. |
250mg/5mL ½ to 1 tsp b.i.d 1 to 2 tsp b.i.d. 2 to 4 tsp b.i.d. |
混合時の注意事項
5mLあたり125mg(混合時は100mL)です。 調剤時に懸濁時間を用意する。 合計67mLの水をボトルに加える。 このとき、ボトルを軽くたたいて粉末をほぐし、水を2回に分けて加え、その都度よく振っておくと調製しやすい。 5mL(ティースプーン1杯)あたり125mgのセファレキシン一水和物を含む懸濁液ができあがる。 調剤時に懸濁時間を調製する。 合計134mLの水をボトルに加える。 このとき、ボトルを軽くたたいて粉末をほぐし、水を2回に分けて加え、その都度よく振っておくと調製しやすい。 5mL(小さじ1杯)あたり125mgのセファレキシン一水和物を含む懸濁液となる。 調剤時に懸濁時間を調製する。 合計67mLの水をボトルに加える。 このとき、ボトルを軽くたたいて粉末をほぐし、水を2回に分けて加え、その都度よく振っておくと調製が容易になる。 5mL(ティースプーン一杯)あたり250mgのセファレキシン一水和物を含む懸濁液が得られる。 調剤時に懸濁時間を調製する。 合計134mLの水をボトルに加える。 このとき、ボトルを軽くたたいて粉末をほぐし、水を2回に分けて加え、その都度よく振っておくと調製しやすい。 5mL(ティースプーン1杯)あたり250mgのセファレキシン一水和物を含む懸濁液ができあがる。
腎障害のある15歳以上の成人および小児患者における用法・用量調節
腎機能の低下した患者には、以下のセファレキシンの用量設定を行うこと
表1. Recommended Dose Regimen for Patients with Renal Impairment
| Renal function | Dose regimen recommendation |
| Creatinine clearance ≥60 mL/min | No dose adjustment |
| Creatinine clearance 30 to 59 mL/min | No dose adjustment; maximum daily dose should not exceed 1 g |
| Creatinine clearance 15 to 29 mL/min | 250 mg, every 8 hours or every 12 hours |
| Creatinine clearance 5 to 14 mL/min not yet on dialysis* | 250 mg, every 24 hours |
| Creatinine clearance 1 to 4 mL/min not yet on dialysis* | 250 mg, 48時間ごと、または60時間ごと |
*血液透析患者における用量調整の推奨には情報が不十分である。
剤形 & 強さ
Cephalexin For Oral Suspension USP
125mg/5mL and 250mg/5mL
禁忌
Cephalexin For Oral Suspension USP
125mg/5mL and 250mg/5mL
& 強さは、次のとおりです。
セファレキシンまたは他のセファロスポリン系抗菌薬に対して過敏症の既知のある患者には禁忌である。
警告と注意
過敏性反応
発疹、蕁麻疹、血管浮腫、アナフィラキシー、多形紅斑、スティーブンス-ジョンソン症候群、または中毒性表皮壊死症の形のアレルギー反応はセファレキシンの使用で報告されています。 セファレキシンによる治療を開始する前に、患者がセファレキシン、セファロスポリン、ペニシリン、または他の薬剤に対する過敏性反応の既往歴があるかどうかを問い合わせてください。
セファレキシンに対するアレルギー反応が発現した場合には、本剤の投与を中止し、適切な処置を行う。
Clostridium difficile関連下痢
クロストリジウム・ディフィシル関連下痢(CDAD)は、セファレキシンを含むほぼすべての抗菌薬の使用で報告されており、軽い下痢から致命的な大腸炎まで重症度が異なる場合があります。
C.difficileは毒素AおよびBを産生し、CDADの発症に寄与します。 C. difficileの高毒素産生株は、これらの感染症が抗菌療法に抵抗性を示し、大腸切除を必要とすることがあるため、病的状態や死亡率の上昇を引き起こします。 CDADは、抗生物質の使用後に下痢を呈するすべての患者において考慮する必要があります。
CDADが疑われる、または確認された場合、C. difficileに対するものではない抗生物質の使用を継続的に中止する必要があるかもしれません。
直接クームス試験血清転換
セファレキシンを含むセファロスポリン系抗菌薬による治療中に、直接クームス試験が陽性であることが報告されています。 セファレキシン投与による急性血管内溶血が報告されている。
痙攣の可能性
いくつかのセファロスポリンは痙攣の誘発に関与しており、特に腎障害のある患者において投与量を減らさなかった場合に痙攣を誘発することが報告されています。 発作が発生した場合は、セファレキシンを中止してください。
プロトロンビン時間の延長
セファロスポリンはプロトロンビン時間の延長と関連している可能性があります。 腎臓や肝臓に障害がある患者、栄養状態が悪い患者、長期間の抗菌療法を受けている患者、抗凝固療法を受けている患者などが危険であるとされている。
薬剤耐性菌の発生
細菌感染が証明されていない、あるいは強く疑われる状態でセファレキシンを処方することは、患者にとって有益であるとは考えにくく、薬剤耐性菌の発生のリスクを高める。
セファレキシンを長期間使用すると、非感受性菌の過剰繁殖を招く可能性がある。 患者の慎重な観察が不可欠である。 治療中に過感染が起こった場合は、適切な処置を行う必要があります。
副作用
以下の重篤な事象は、警告と注意のセクションでより詳細に説明されています。
– 過敏症反応
– クロストリジウム・ディフィシル関連下痢
– ダイレクトクームス試験血清反応
– 発作可能性
– プロトロンビン活性への影響
– 薬剤耐性菌の発生
臨床試験の経験
臨床試験は大きく異なる条件の下で行われているため、臨床試験を行う際には注意が必要です。 ある医薬品の臨床試験で観察された副作用の割合は、他の医薬品の臨床試験での割合と直接比較することはできず、実際に観察される割合を反映していない可能性があります。
臨床試験において、最も頻度の高い副作用は下痢でした。 また、悪心・嘔吐、消化不良、胃炎、腹痛も発生しています。
その他、過敏症、性器・肛門掻痒症、性器カンジダ症、膣炎および膣分泌物、めまい、疲労、頭痛、激越、錯乱、幻覚、関節痛、関節障害などが報告されています。 可逆性間質性腎炎が報告されている。 好酸球増多、好中球減少、血小板減少、溶血性貧血、アスパラギン酸トランスアミナーゼ(AST)およびアラニントランスアミナーゼ(ALT)の軽度上昇が報告されています。
セファレキシンで治療した患者に認められた上記の副作用に加えて、セファロスポリン系の抗菌薬では以下の副作用およびその他の臨床検査値の変化が報告されています:
その他の副反応。 発熱、大腸炎、再生不良性貧血、出血、腎機能障害、中毒性腎症
臨床検査値の変化。 プロトロンビン時間の延長、血中尿素窒素(BUN)上昇、クレアチニン上昇、アルカリホスファターゼ上昇、ビリルビン上昇、乳酸脱水素酵素(LDH)上昇、汎血球減少、白血球減少、無顆粒球症など。
薬物相互作用
メトホルミン
メトホルミンにセファレキシンを投与すると、血漿メトホルミン濃度の上昇とメトホルミンの腎クリアランスが減少する。
セファレキシンとメトホルミンを併用する患者には、注意深い患者モニタリングとメトホルミンの用量調節が推奨される。
プロベネシド
セファレキシンの腎排泄はプロベネシドにより阻害される。
臨床検査・診断との相互作用
ベネディクト液やフェーリング液を用いて尿中のブドウ糖の有無を調べる際に、偽陽性反応が起こることがあります。
特定集団における使用
妊娠
妊娠カテゴリーB
妊婦における適切でよく管理された研究はない。 動物の繁殖研究は必ずしも人間の反応を予測するものではないので、この薬は明らかに必要な場合のみ妊娠中に使用されるべきである。
マウスとラットで、セファレキシン一水和物の経口投与量0.5mgを使用して繁殖研究が行われている。
授乳婦
セファレキシンはヒトの母乳に排泄されます。
小児用
小児患者におけるセファレキシンの安全性と有効性は、用法・用量に記載された用量の臨床試験で確立されています。
老人用
セファレキシンの3つの公開臨床試験の被験者701人のうち433人(62%)は65歳以上でした。 これらの被験者と若い被験者との間で安全性または有効性の全体的な違いは観察されず、他の報告された臨床経験でも高齢者と若い患者の反応の違いは確認されていません。
本剤は腎臓から大幅に排泄され、本剤の毒性反応のリスクは腎機能が低下した患者で大きくなることがあります。 高齢者では腎機能が低下しやすいため、投与量の選択に注意が必要です。
腎障害
セファレキシンは腎機能障害(クレアチニンクリアランス< 30mL/min、透析の有無)がある場合は慎重に投与する必要があります。
過量投与
経口過量投与の症状として、吐き気、嘔吐、心窩部痛、下痢、血尿があらわれることがあります。
セファレキシン懸濁液の説明
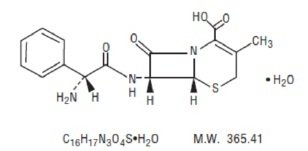
セファレキシン懸濁液(USP)は、経口投与を目的とした半合成セファロスポリン系抗菌薬である。 7-(D-α-アミノ-α-フェニルアセトアミド)-3-メチル-3-セフェム-4-カルボン酸一水和物である。 セファレキシンは分子式C16H17N3O4S-H2Oで、分子量は365.41です。
セファレキシンは次の構造式を持ちます:
有効成分。 コロイド状二酸化ケイ素、FD&C Red # 40、メチルセルロース(15プレミアムLV)、メチルセルロース(4ACプレミアム)、安息香酸ナトリウム、イチゴ風味、スクロース、キサンタンガム。
セファレキシン懸濁液-臨床薬理
作用機序
セファレキシンはセファロスポリン系の抗菌薬である。
薬物動態
吸収:
セファレキシンは酸安定で、食事を気にせず投与することが可能である。 250mg、500mg、1gの投与後、1時間後の平均ピーク血清レベルはそれぞれ約9、18、32mcg/mLであった。
分布:
セファレキシンは血漿蛋白と約10~15%結合している。
排泄:
セファレキシンは糸球体濾過及び尿細管分泌により尿中に排泄される。 8時間以内に90%以上が未変化体のまま尿中に排泄されることが確認されています。 この間、250mg、500mg、1g投与後の尿中ピーク濃度はそれぞれ約1000、2200、5000mcg/mLでした。
薬物相互作用:
健康者にセファレキシン500mgを単回投与しメトホルミンを投与すると、血漿メトホルミン平均CmaxとAUCがそれぞれ平均34%と24%増加、メトホルミン平均腎臓クリアランスが14%減少した。
微生物学
セファレキシンは細菌の細胞壁合成の阻害によって作用する殺菌剤です。
耐性
メチシリン耐性ブドウ球菌と腸球菌のほとんどの分離株はセファレキシンに耐性があります。 セファレキシンは、Enterobacter spp.、Morganella morganii、およびProteus vulgarisのほとんどの分離株に対して有効ではありません。 セファレキシンは、Pseudomonas spp.、Acinetobacter calcoaceticusに対しては活性を持ちません。
抗菌活性
セファレキシンは、in vitroおよび臨床感染の両方で、以下の細菌のほとんどの分離に対して活性であることが示されている。
グラム陽性菌
黄色ブドウ球菌(メチシリン感受性分離株のみ) 肺炎球菌(ペニシリン感受性分離株) 化膿レンサ球菌
グラム陰性菌
グラム陽性菌
グラム陰性菌
グラム陽性菌
グラム陰性菌
グラム陽性菌
グラム陰性菌
グラム陽性菌
グラム陰性菌
.陰性菌 大腸菌 インフルエンザ菌 肺炎球菌 モラクセラ・カタルハリス プロテウス・ミラビリス
感受性試験
感受性試験の解釈基準、関連試験方法、本剤についてFDAが認めた品質管理基準に関する具体的な情報については、こちらをご覧ください。 をご覧ください。 https://www.fda.gov/STIC.
Nonclinical Toxicology
Carcinogenesis & Mutagenesis & Impairment Of Fertility
Lifetime studies in animals have not been performed to evaluate the carcinogenic potential of cephalexin. Tests to determine the mutagenic potential of cephalexin have not been performed. In male and female rats, fertility and reproductive performance were not affected by cephalexin oral doses up to 1.5 times the highest recommended human dose based upon body surface area.
How Supplied/Storage and Handling
Cephalexin for oral suspension* USP (a strawberry flavored formula) is supplied as follows:
125 mg/5 mL:
Bottles of 100 mL (NDC 67877-544-88)
Bottles of 200 mL (NDC 67877-544-68)
250 mg/5 mL:
Bottles of 100 mL (NDC 67877-545-88)
Bottles of 200 mL (NDC 67877-545-68)
Directions for mixing are included on the label.
20℃~25℃で保管してください。
使用前によく振ってください。
*混合後は冷蔵庫に保管してください。
患者相談情報
- 重篤なアレルギー反応を含むアレルギー反応が起こりうること、重篤な反応は直ちに治療を要することを患者に説明してください。 セファレキシン、他のβラクタム系抗菌薬(セファロスポリンを含む)、他のアレルゲンに対する過去の過敏性反応について患者に尋ねます(5.1)
- 下痢は抗菌薬による共通の問題で、通常は薬を中止すると治ることを患者に説明します。 時々、頻繁に水様または血様の下痢が起こることがあり、より深刻な腸内感染の徴候である可能性があります。
- セファレキシンを含む抗菌薬は、細菌感染症の治療にのみ使用されるべきであることを患者に説明します。 ウイルス感染症(例:風邪)の治療には使用しない。 セファレキシンが細菌感染症の治療のために処方された場合、治療の初期には気分が良くなるのが一般的ですが、薬は指示通りに正確に服用する必要があることを患者に伝えてください。
インドでは、
Alkem Laboratories Ltd.によって製造されています。
Mumbai – 400013, INDIA.
販売元:
Ascend Laboratories, LLC
Parsippany, NJ 07054
改訂版。 December, 2018
PT 2851
PACKAGE LABEL.PRINCIPAL DISPLAY PANEL
NDC 67877-544-88
Cephalexin for Oral Suspension, USP 125 mg per 5 mL
指示に従って再構成した場合
通常の小児の用量:1kgあたり25~50mgを4分割して投与すること。 より重篤な感染症には、投与量を2倍にすることができる。
Rx only
For Oral Use only
100 mL (when mixed)
Ascend Laboratories, LLC

NDC 67877-545-88
Cephalexin for Oral Suspension, USP 250 mg per 5 mL
when reconstituted according to directions.(「指示に従って再構成する」)
セファレキシン・フォー・オーラル・サスペンション、USP 250 mg per 5 mL
。
通常の小児用量:1日1kgあたり25~50mgを4回に分けて服用する。 より重篤な感染症には、投与量を2倍にすることができる。
添付文書を参照のこと。
Rx only
For Oral Use only
100 mL (when mixed)
Ascend Laboratories, LLC

| CEPHALEXIN cephalexin for suspension |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CEPHALEXIN cephalexin for suspension |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Ascend Laboratories, LLC (141250469)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Alkem Laboratories Limited | 915628612 | MANUFACTURE(67877-544, 67877-545) | |
Frequently asked questions
- What are the best antibiotics for a tooth infection?
- Cephalexin – can this be used to treat an abscess in the mouth or gum infection?
- If people are allergic to amoxicillin can they take cephalexin?
- What is the best antibiotic to treat strep throat?
- Can you take cephalexin for a spider bite?
- Can you take antibiotics while pregnant?
- Cephalexin – is this a drug that can be abused by teens?
More about cephalexin
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Patient Tips
- Drug Images
- Drug Interactions
- Compare Alternatives
- Support Group
- Pricing & Coupons
- En Español
- 415 Reviews
- Drug class: first generation cephalosporins
Consumer resources
- Patient Information
- Cephalexin (Advanced Reading)
Professional resources
- Prescribing Information
- Cephalexin (Professional Patient Advice)
- Cephalexin (FDA)
- Cephalexin Tablets (FDA)
Other brands Keflex, Daxbia, Panixine
Related treatment guides
- Bacterial Infection
- Bladder Infection
- Bacterial Endocarditis Prevention
- Acne
- … +7 more
Medical Disclaimer