Formal Charges
As moléculas orgânicas também podem ter cargas positivas ou negativas associadas a elas. Durante as reacções químicas, é comum ter reagentes de carga, intermediários e/ou produtos. O reconhecimento e a distinção entre padrões de ligação neutros e carregados será útil na aprendizagem dos mecanismos de reacção. Considere a estrutura Lewis do metanol, CH3OH (o metanol é o chamado “álcool de madeira” que os contrabandistas inescrupulosos às vezes vendiam durante os dias de proibição nos anos 20, muitas vezes fazendo com que as pessoas que o bebiam ficassem cegas). O metanol em si é uma molécula neutra, mas pode perder um próton para se tornar um ânion molecular (CH3O-), ou ganhar um próton para se tornar um cátion molecular (CH3OH2+).

O ânion molecular e o cátion molecular têm cargas totais de -1 e +1, respectivamente. Mas podemos ser mais específicos que isso – também podemos afirmar para cada íon molecular que uma carga formal está localizada especificamente no átomo de oxigênio, em vez de no carbono ou em qualquer um dos átomos de hidrogênio.
Figurar a carga formal em diferentes átomos de uma molécula é um processo simples – é simplesmente uma questão de somar electrões de valência.
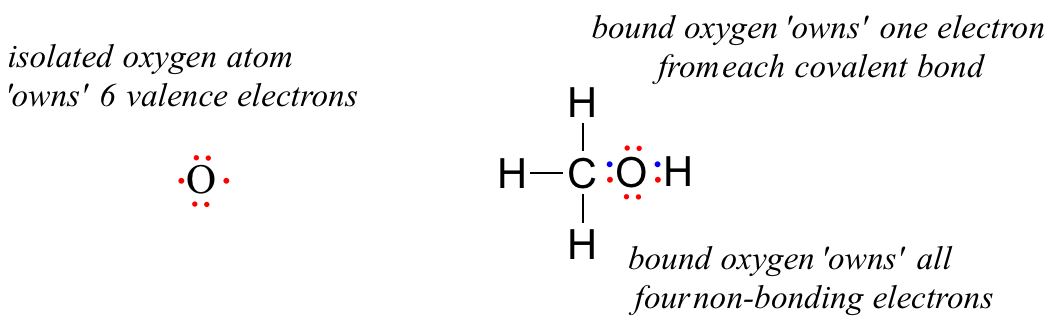
Um átomo de oxigénio não ligado tem 6 electrões de valência. Quando é ligado como parte de uma molécula de metanol, porém, um átomo de oxigênio é cercado por 8 elétrons de valência: 4 elétrons sem ligação (dois ‘pares solitários’) e 2 elétrons em cada uma de suas duas ligações covalentes (um ao carbono, outro ao hidrogênio). Na convenção formal de carga, dizemos que o oxigênio ‘possui’ todos os 4 elétrons sem ligação. No entanto, ele ‘possui’ apenas um elétron de cada uma das duas ligações covalentes, porque as ligações covalentes envolvem a partilha de elétrons entre os átomos. Portanto, o átomo de oxigênio no metanol possui 2 + 2 + (½ x 4) = 6 elétrons de valência.
The formal charge on an atom is calculated as the number of valence electrons owned by the isolated atom minus the number of valence electrons owned by the bound atom in the molecule:
Determining formal charge on an atom
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of valence electrons owned by the bound atom)
or . . .
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of non-bonding electrons on the bound atom)
– ( ½ the number of bonding electrons on the bound atom)
Using this formula for the oxygen atom of methanol, we have:
formal charge on oxygen =
(6 valence electrons on isolated atom)
– (4 non-bonding electrons)
– (½ x 4 bonding electrons)
= 6 – 4 – 2 = 0. Thus, oxygen in methanol has a formal charge of zero (in other words, it has no formal charge).
How about the carbon atom in methanol? An isolated carbon owns 4 valence electrons. The bound carbon in methanol owns (½ x 8) = 4 valence electrons:
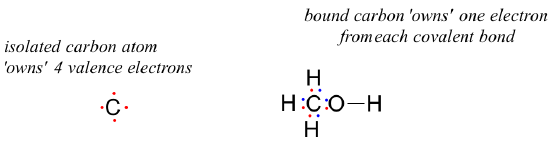
formal charge on carbon =
(4 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 8 bonding electrons)
= 4 – 0 – 4 = 0. So the formal charge on carbon is zero.
For each of the hydrogens in methanol, we also get a formal charge of zero:
formal charge on hydrogen =
(1 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 2 bonding electrons)
= 1 – 0 – 1 = 0
Now, let’s look at the cationic form of methanol, CH3OH2+. The bonding picture has not changed for carbon or for any of the hydrogen atoms, so we will focus on the oxygen atom.
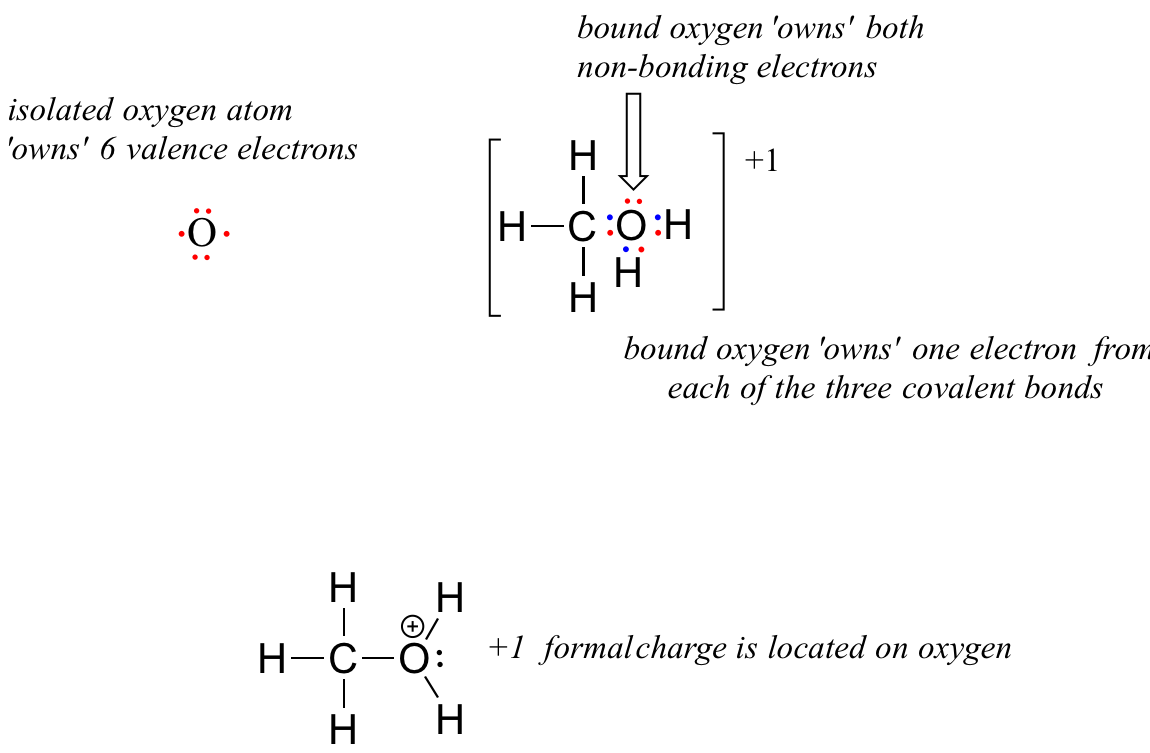
The oxygen owns 2 non-bonding electrons and 3 bonding elections, so the formal charge calculations becomes:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (2 non-bonding electrons)
– (½ x 6 bonding electrons)
= 6 – 2 – 3 = 1. A formal charge of +1 is located on the oxygen atom.
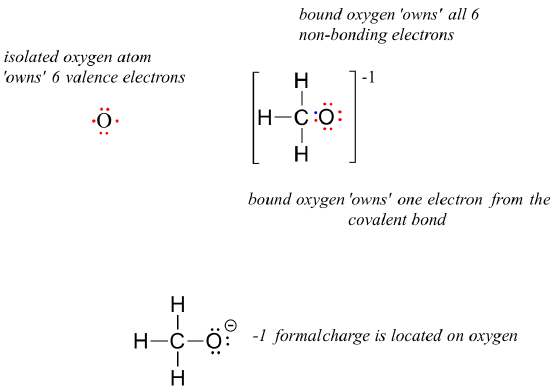
For methoxide, the anionic form of methanol, the calculation for the oxygen atom is:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (6 non-bonding electrons)
– (½ x 2 bonding electrons)
= 6 – 6 – 1 = -1. A formal charge of -1 is located on the oxygen atom.
A very important rule to keep in mind is that the sum of the formal charges on all atoms of a molecule must equal the net charge on the whole molecule.
Ao desenhar as estruturas das moléculas orgânicas, é muito importante mostrar todas as cargas formais não-zero, sendo claro onde as cargas estão localizadas. Uma estrutura que está faltando cargas formais não-zero não é desenhada corretamente, e provavelmente será marcada como tal em um exame!
Neste ponto, pensando no que você aprendeu em química geral, você provavelmente está perguntando “E quanto a dipolos? Um átomo de oxigênio em uma ligação O-H não ‘possui’ mais da densidade de elétrons do que o hidrogênio, por causa de sua maior eletronegatividade”? Isto é absolutamente correcto, e iremos rever o conceito de dipolos de ligação mais tarde. Para efeitos de cálculo das cargas formais, contudo, os dipolos de ligação não importam – consideramos sempre que os dois electrões de uma ligação são partilhados igualmente, mesmo que isso não seja um reflexo exacto da realidade química. As cargas formais são apenas isso – uma formalidade, um método de contabilidade de electrões que está ligado ao sistema Lewis para desenhar as estruturas dos compostos orgânicos e iões. Mais tarde, veremos como o conceito de carga formal pode nos ajudar a visualizar como as moléculas orgânicas reagem.
Finalmente, não seja atraído a pensar que só porque a carga líquida em uma estrutura é zero, não há átomos com cargas formais: um átomo poderia ter uma carga formal positiva e outro uma carga formal negativa, e a carga líquida ainda seria zero. Zwitterions, como os aminoácidos, têm cargas formais positivas e negativas em diferentes átomos:

P>Even embora a carga líquida sobre a glicina seja zero, ainda é necessário mostrar a localização das cargas formais positivas e negativas.
Exercício 1.4
Preencher todos os elétrons de pares solitários e cargas formais em falta nas estruturas abaixo. Assumir que todos os átomos têm uma concha de valência completa de elétrons. As cargas líquidas são mostradas fora dos parênteses.
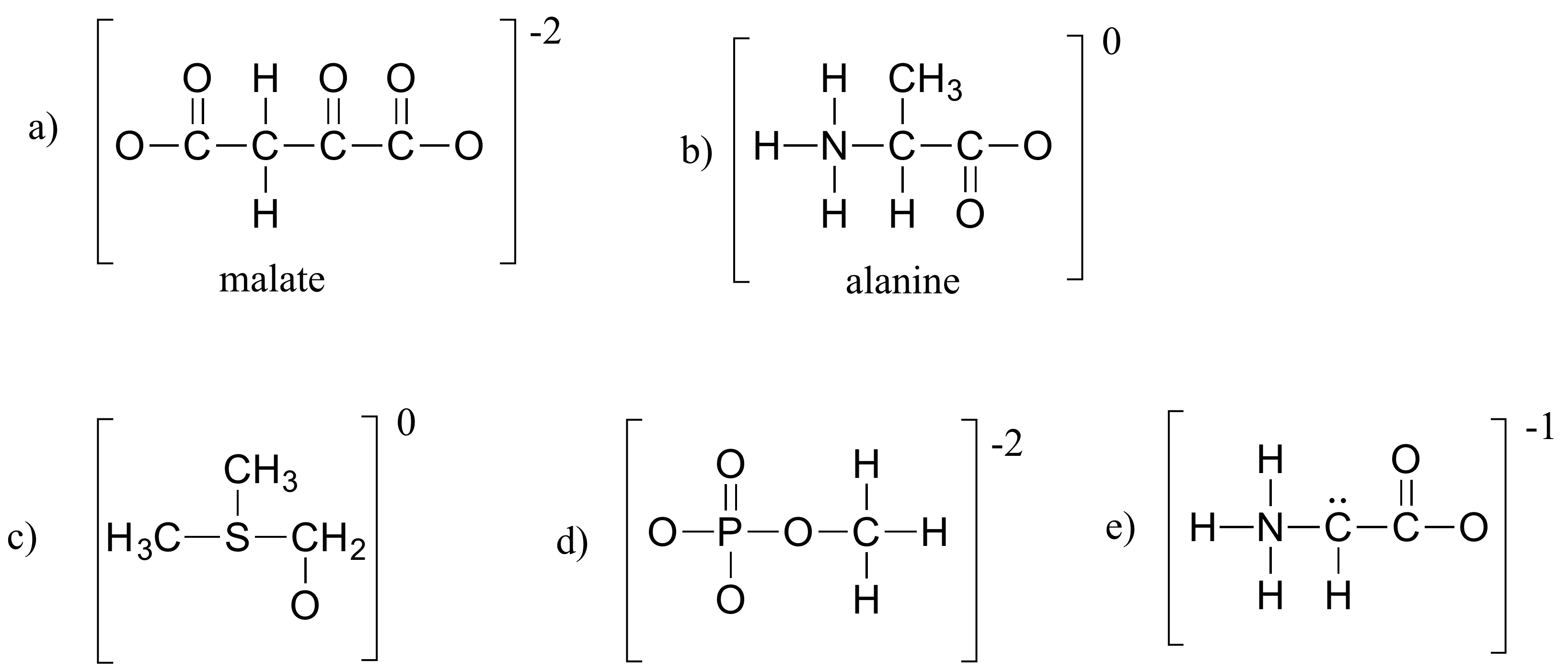
Soluções aos exercícios