Teoria MO e ligações conjugadas pi
A vantagem de usar a teoria MO para compreender a ligação em moléculas orgânicas torna-se mais aparente quando pensamos em ligações pi. Vamos primeiro considerar a ligação pi em eteno do ponto de vista da teoria MO (neste exemplo estaremos desconsiderando as ligações s na molécula, e pensando apenas na ligação π). Começamos com duas orbitais atômicas: uma orbital não-hibridizada de 2p de cada carbono. Cada uma contém um único elétron. Na teoria de MO, os dois atômicos combinam-se matematicamente para formar dois orbitais moleculares pi, um orbital de ligação pi de baixa energia e outro orbital anti-ligação pi* de alta energia.
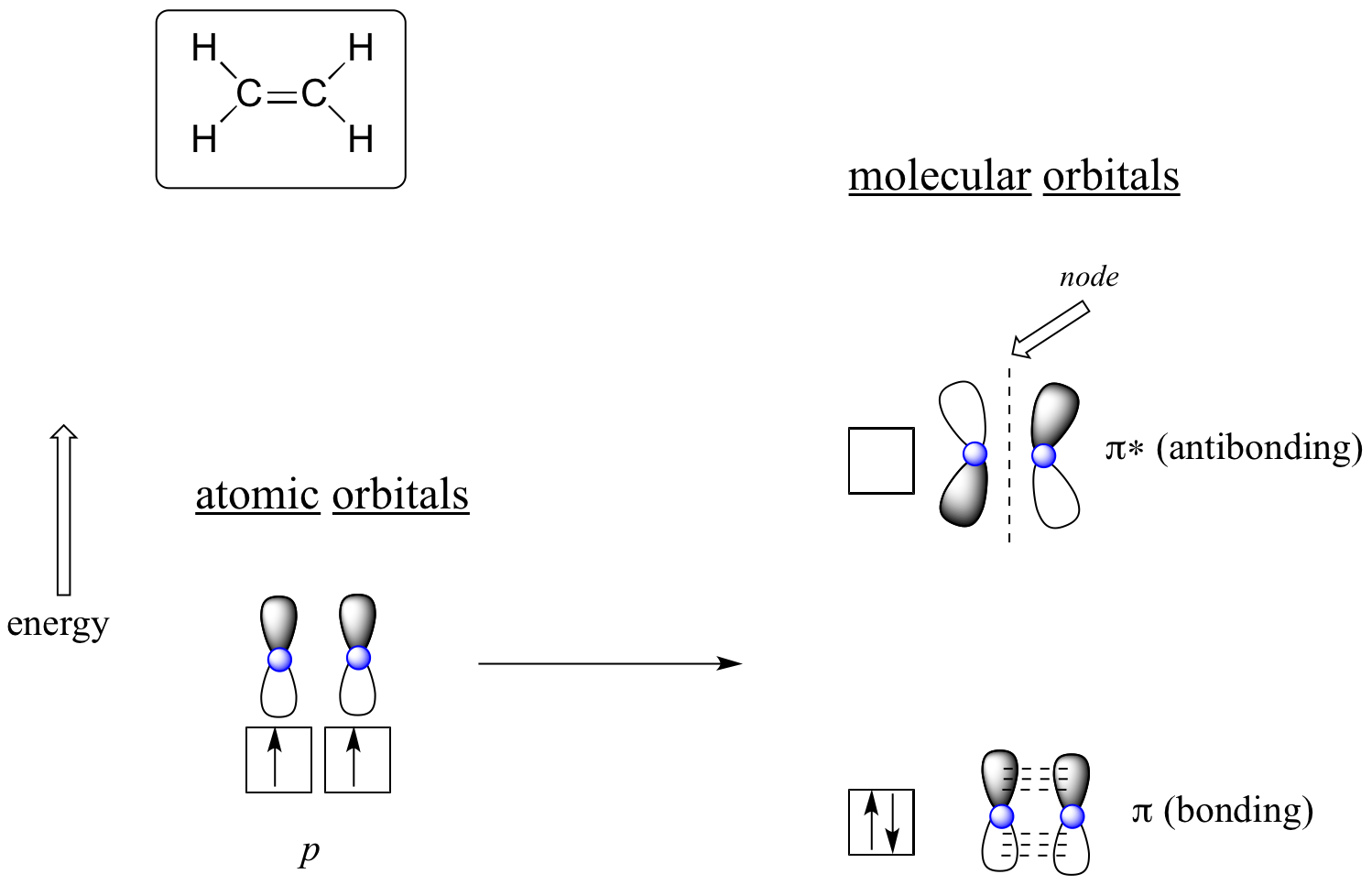
Orbitais moleculares para etileno (etileno)
No orbital pi de ligação, os dois lóbulos sombreados dos orbitais p interagem construtivamente um com o outro, assim como os dois lóbulos não sombreados (lembre-se, a escolha arbitrária de sombreamento representa sinais matemáticos (+) e (-) para a função de onda matemática descrevendo o orbital). Há aumento da densidade de elétrons entre os dois núcleos de carbono no orbital molecular – é uma interação de ligação.
No orbital pi* de maior energia antibondante, o lóbulo sombreado de um orbital p interage destrutivamente com o lóbulo sem sombras do segundo orbital p, levando a um nó entre os dois núcleos e repulsão geral entre os núcleos de carbono.
Again usando o princípio ‘building up’, nós colocamos os dois elétrons no orbital molecular pi de baixo consumo de energia, ligando pi. O orbital pi* anti-ligação permanece vazio.
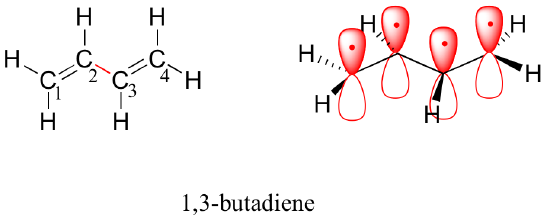
P>Próximo, vamos considerar a molécula de 1,3-butadieno. Somente da teoria orbital de valência podemos esperar que a ligação C2-C3 nesta molécula, por ser uma ligação sigma, seria capaz de girar livremente.

Experimentalmente, entretanto, observa-se que existe uma barreira significativa à rotação sobre a ligação C2-C3, e que toda a molécula é planar. Além disso, a ligação C2-C3 tem 148 horas de comprimento, menor que uma típica ligação simples de carbono carbono (cerca de 154 horas), embora mais longa que uma típica ligação dupla (cerca de 134 horas).
Teoria orbital orbital molecular contabiliza estas observações com o conceito de ligações pi delocalizadas. Nesta figura, as quatro orbitais atômicas de 2p combinam-se matematicamente para formar quatro orbitais moleculares pi de energia crescente. Duas delas – as orbitais pi de ligação – são de menor energia que as orbitais p atômicas a partir das quais são formadas, enquanto duas – as orbitais pi* de anti ligação – são maiores em energia.

O orbital molecular de menor energia, pi1, tem apenas interação construtiva e zero nós. O orbital pi2 tem um nó, mas duas interações construtivas – portanto, ainda é um orbital de ligação em geral. Olhando para os dois orbitais anti-ligação, pi3* tem dois nós e uma interação construtiva, enquanto pi4* tem três nós e zero interações construtivas.
Pelo princípio aufbau, os quatro elétrons dos orbitais atômicos isolados de 2pz são colocados nos MO’s de ligação pi1 e pi2. Como pi1 inclui interação construtiva entre C2 e C3, existe um grau, na molécula de 1,3-butadieno, de interação pi-bonding entre esses dois carbonos, o que explica o seu menor comprimento e a barreira à rotação. A imagem da ligação de valência do 1,3-butadieno mostra as duas ligações de pi como estando isoladas uma da outra, com cada par de pi elétrons ‘presos’ em sua própria ligação de pi. Entretanto, a teoria molecular orbital prevê (com precisão) que os quatro elétrons pi estão até certo ponto deslocalizados, ou ‘espalhados’, por todo o sistema pi.
vista de preenchimento de espaço
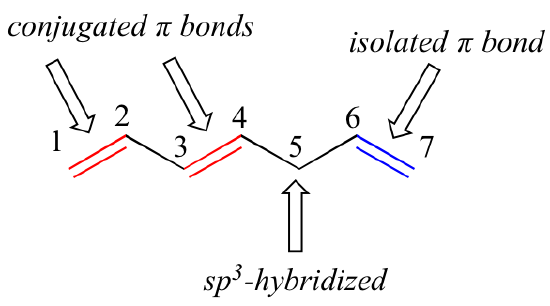
1,3-butadieno é o exemplo mais simples de um sistema de ligações pi conjugadas. Para ser considerado conjugado, duas ou mais ligações pi devem ser separadas por uma única ligação – em outras palavras, não pode haver um carbono hibridizado sp3 interveniente, pois isso quebraria o sistema sobreposto de orbitais p paralelos. No composto abaixo, por exemplo, as ligações duplas C1-C2 e C3-C4 são conjugadas, enquanto a ligação dupla C6-C7 é isolada das outras duas ligações pi por sp3-hibridizado C5.
Um conceito muito importante a ter em mente é que existe uma estabilidade termodinâmica inerente associada à conjugação. Esta estabilidade pode ser medida experimentalmente comparando o calor da hidrogenação de dois dienos diferentes. (A hidrogenação é um tipo de reação que aprenderemos muito mais no capítulo 15: essencialmente, é o processo de adição de uma molécula de hidrogênio – dois prótons e dois elétrons – a uma ligação p). Quando as duas ligações duplas conjugadas de 1,3-pentadieno são ‘hidrogenadas’ para produzir pentano, cerca de 225 kJ são liberados por molécula de pentano formada. Compare isso com os aproximadamente 250 kJ/mol liberados quando as duas ligações duplas isoladas de 1,4-pentadieno são hidrogenadas, formando também pentano.
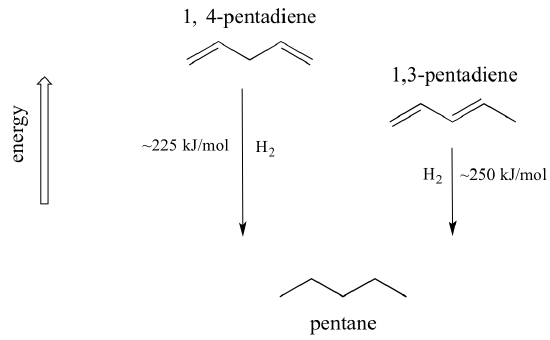
O dieno conjugado é menor em energia: em outras palavras, é mais estável. Em geral, as ligações pi conjugadas são mais estáveis do que as ligações pi isoladas.
Os sistemas pi conjugados podem envolver átomos de oxigénio e nitrogénio, bem como carbono. No metabolismo das moléculas de gordura, algumas das principais reacções envolvem alcenos que são conjugados a grupos carbonilo.

No capítulo 4, veremos que a teoria MO é muito útil para explicar porque é que moléculas orgânicas que contêm sistemas alargados de ligações pi conjugadas têm frequentemente cores distintas. O beta-caroteno, o composto responsável pela cor laranja das cenouras, tem um sistema estendido de 11 ligações conjugadas de pi.
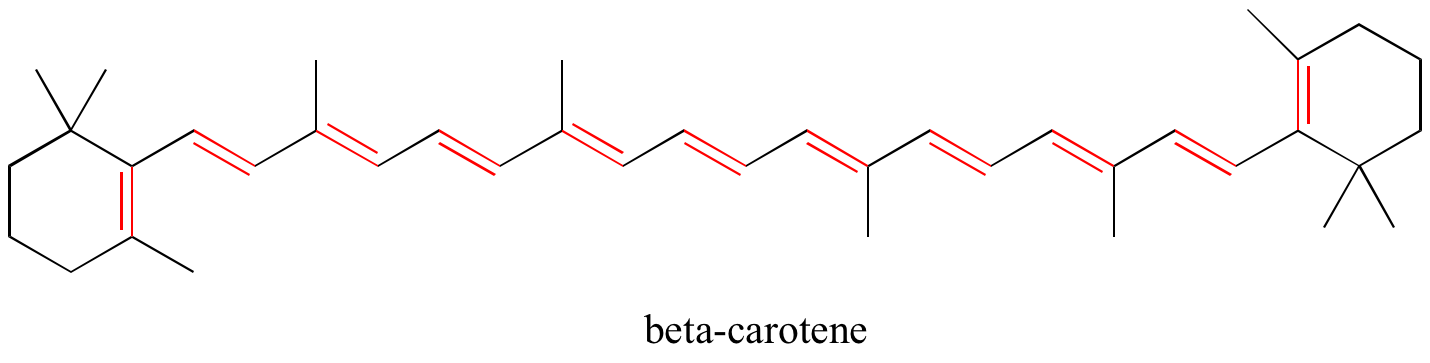
Exercício: Identificar todas as ligações duplas conjugadas e isoladas nas estruturas abaixo. Para cada sistema pi conjugado, especifique o número de orbitais p sobrepostos, e quantos elétrons pi são compartilhados entre eles.
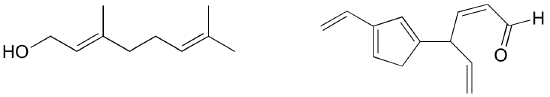
Exercício: Identificar todas as ligações pi isoladas e conjugadas em licopeno, o composto de cor vermelha do tomate. Quantos pi electrões estão contidos no sistema pi conjugado?
Soluções aos exercícios
Aromaticidade – O Último Sistema Conjugado
Teoria orbitalo molecular é especialmente útil para explicar as propriedades únicas dos compostos aromáticos como o benzeno:
3D modelo interactivo de benzeno
Embora o benzeno seja mais frequentemente extraído com três ligações duplas e três ligações simples, de facto todas as ligações carbono-carbono têm exactamente o mesmo comprimento (138 pm). Além disso, as ligações pi em benzeno são significativamente menos reactivas do que as ligações pi “normais”, isoladas ou conjugadas. Algo sobre a estrutura do benzeno torna o seu arranjo de ligação pi especialmente estável. Este ‘algo’ tem um nome: chama-se ‘aromaticidade’.
Qual é exactamente esta propriedade ‘aromática’ que torna as ligações de pi no benzeno tão estáveis? Em grande parte, a resposta a esta pergunta reside no facto de o benzeno ser uma molécula cíclica na qual todos os átomos do anel são hibridizados com sp2. Isto permite que os elétrons pi sejam deslocalizados em orbitais moleculares que se estendem por todo o anel, acima e abaixo do plano. Para que isso aconteça, é claro, o anel deve ser plano – caso contrário, os orbitais p não poderiam se sobrepor corretamente. O benzeno é de facto conhecido por ser uma molécula plana.
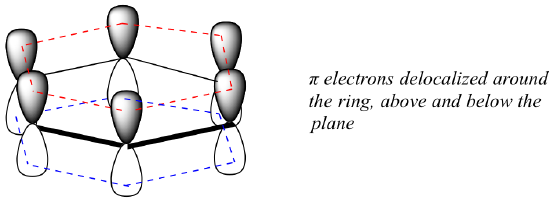
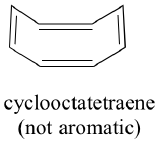
Todas as moléculas cíclicas com ligações alternadas simples e duplas têm esta mesma estabilidade aromática? A resposta, na verdade, é ‘não’. O anel de ciclooctatetraeno de oito membros mostrado abaixo não é plano, e suas ligações π reagem como alcenos ‘normais’.
Claramente é necessário algo mais para ser aromático, e isto pode ser melhor explicado com a teoria orbital molecular. Vejamos um diagrama energético dos orbitais moleculares pi em benzeno.
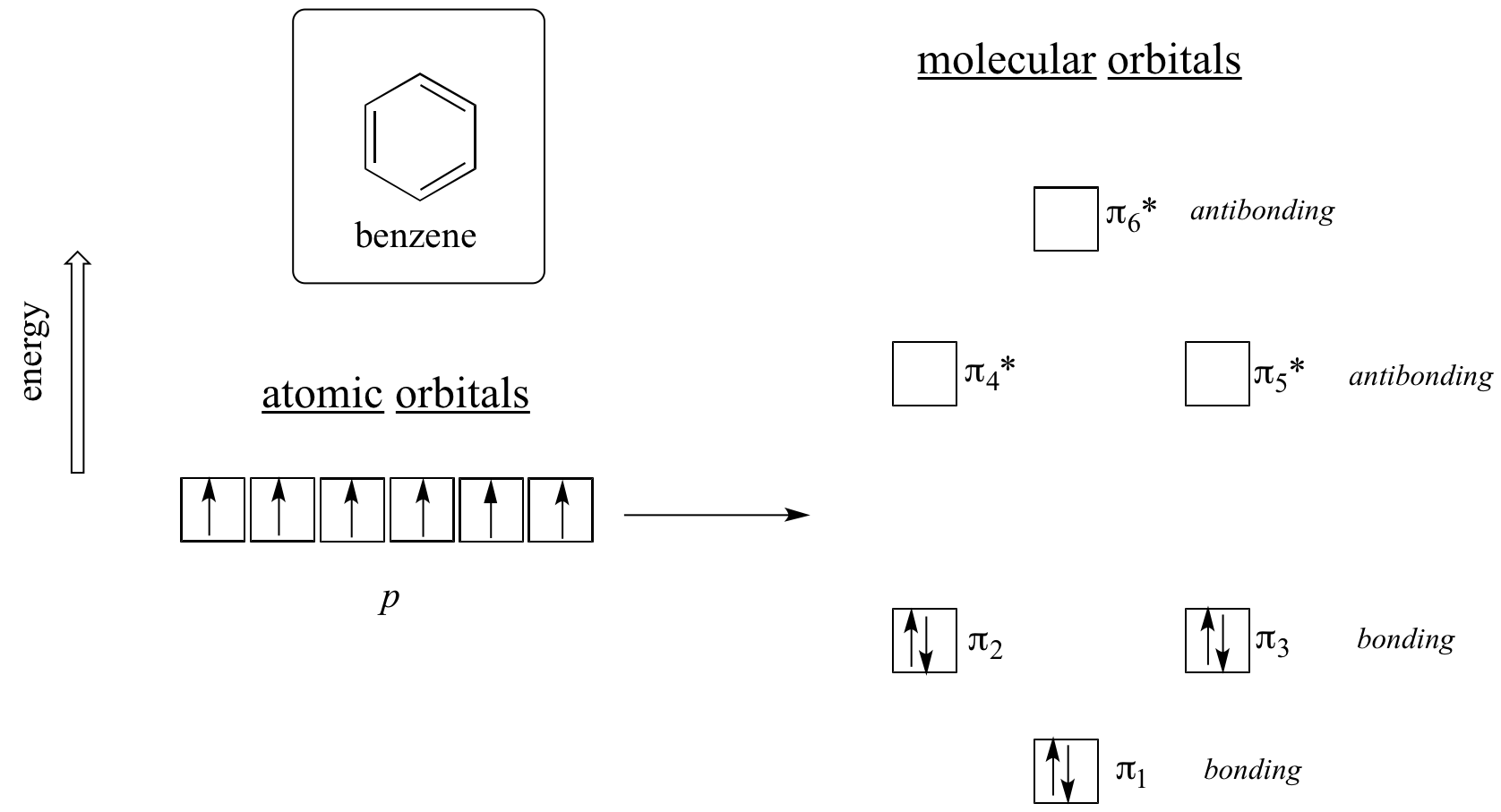
Cálculos mecânicos quânticos nos dizem que os orbitais moleculares de seis pi em benzeno, formados a partir de seis orbitais atômicos p, ocupam quatro níveis de energia separados. pi1 e pi6* têm níveis de energia únicos, enquanto os pares pi2 – pi3 e pi4*- pi5* são degenerados, ou seja, estão no mesmo nível de energia. Quando usamos o princípio aufbau para encher estes orbitais com os seis pi electrões em benzeno, vemos que os orbitais de ligação estão completamente cheios e os orbitais anti-ligação estão vazios. Isto nos dá uma boa pista para a fonte da estabilidade especial do benzeno: um conjunto completo de MO’s de ligação é semelhante em muitos aspectos à “casca completa” dos elétrons nos orbitais atômicos dos gases nobres estáveis hélio, néon e argônio.
Agora, vamos fazer a mesma coisa para o ciclooctatetraeno, que já aprendemos que não é aromático.
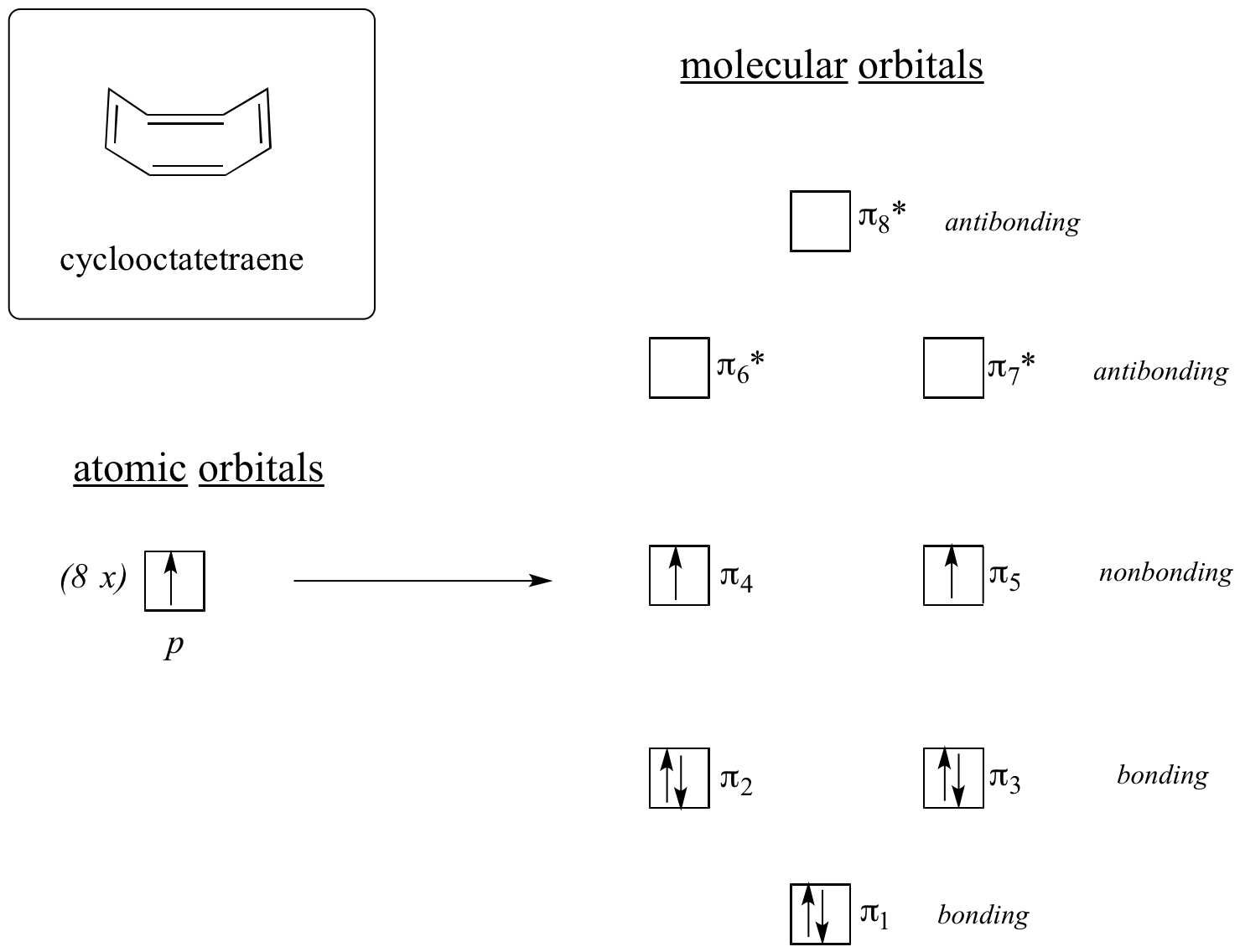
O resultado dos cálculos orbitais moleculares nos diz que os MOs de menor e maior energia (pi1 e pi8*) têm níveis de energia únicos, enquanto os outros seis formam pares degenerados. Note-se que pi4 e pi5 estão no mesmo nível de energia que os orbitais atómicos isolados de 2pz: não são, portanto, nem de ligação nem anti-ligação, mas sim referidos como MOs não de ligação. Enchendo os MOs com os oito pi electrões na molécula, verificamos que os dois últimos electrões não são emparelhados e caem nas duas orbitais degeneradas sem ligação. Como não temos uma concha perfeita de MOs de ligação, a nossa molécula não é aromática. Como consequência, cada uma das ligações duplas no ciclooctatetraeno age mais como uma ligação dupla isolada.
Por enquanto, o importante objectivo de aprendizagem é reconhecer sistemas de ligações pi conjugadas e compreender que o benzeno é excepcionalmente estável, exibindo uma propriedade chamada aromaticidade. A aromaticidade e a química dos compostos aromáticos é relativamente complexa e é discutida em maior detalhe nos capítulos subsequentes deste texto.
Química Orgânica com Ênfase Biológica por Tim Soderberg (Universidade de Minnesota, Morris)