Electronegatividade e Polaridade das Ligações
Embora definamos a ligação covalente como a partilha de electrões, os electrões de uma ligação covalente nem sempre são partilhados igualmente pelos dois átomos ligados. A menos que a ligação ligue dois átomos do mesmo elemento, como em H2, haverá sempre um átomo que atrai os elétrons da ligação mais fortemente do que o outro átomo, como em HCl, mostrado na Figura {1}(PageIndex{1}}). Uma ligação covalente que tem um compartilhamento igual de elétrons (Figura 1a) é chamada de ligação covalente não-polar. Uma ligação covalente que tem um compartilhamento desigual de elétrons, como na Figura 1b, é chamada de ligação covalente polar.

A distribuição da densidade de elétrons em uma ligação polar é desigual. É maior ao redor do átomo que atrai os elétrons mais do que o outro. Por exemplo, os elétrons na ligação H-Cl de uma molécula de cloreto de hidrogênio passam mais tempo perto do átomo de cloro do que perto do átomo de hidrogênio. Note que a área sombreada em torno de Cl na Figura \(\PageIndex{1b}\) é muito maior do que em torno de H.
Este desequilíbrio na densidade de elétrons resulta em um acúmulo de carga parcialmente negativa (designada como δ-) em um lado da ligação (Cl) e uma carga parcialmente positiva (designada como δ+) no outro lado da ligação (H). Isto é visto na Figura \PageIndex{2a}). A separação da carga em uma ligação polar covalente resulta em um dipolo elétrico (dois pólos), representado pela seta na Figura \PageIndex (2b)). A direção da seta está apontada para o extremo δ- enquanto que a + cauda da seta indica o extremo δ+ da ligação.
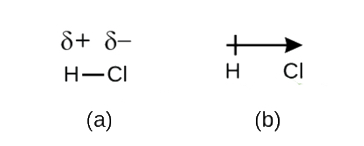
Figure \(\PageIndex{2}}): (a) A partilha desigual do par de electrões de ligação entre H e Cl leva a uma carga positiva parcial no átomo de H e a uma carga negativa parcial no Cl. Símbolos δ+ e δ- indicam a polaridade da ligação H-Cl. (b) O dipolo é representado por uma seta com uma cruz na cauda. A cruz está próxima à extremidade do δ+ e a ponta da seta coincide com o δ-.
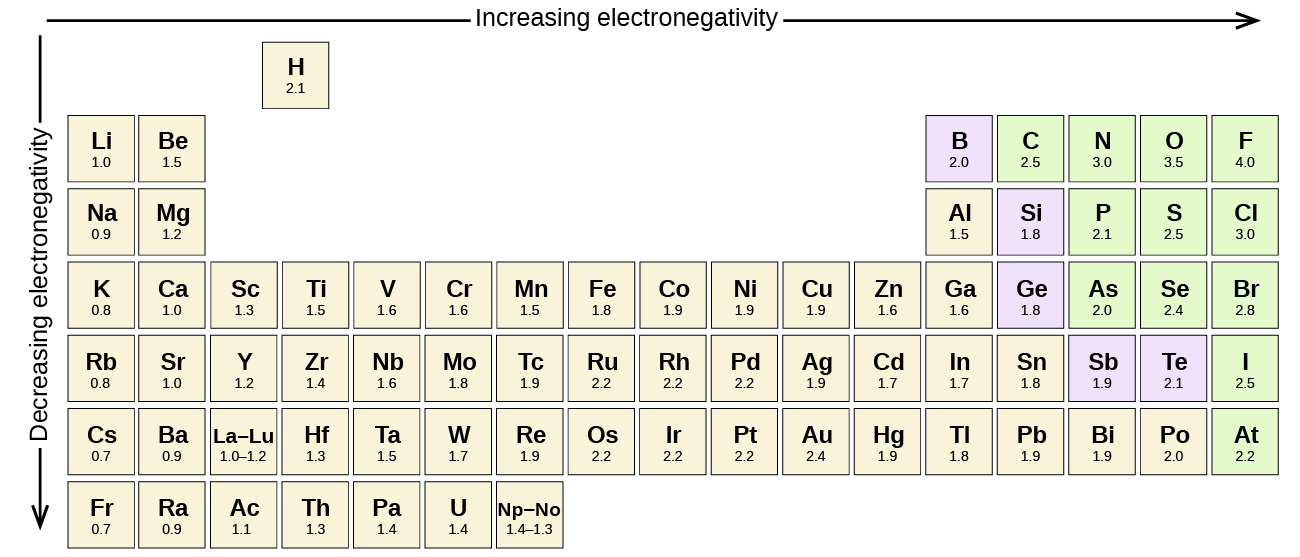
Any covalent bond entre átomos de diferentes elementos é uma ligação polar, mas o grau de polaridade varia muito. Algumas ligações entre diferentes elementos são apenas minimamente polares, enquanto outras são fortemente polares. Ligações iônicas podem ser consideradas a última palavra em polaridade, com elétrons sendo transferidos ao invés de compartilhados. Para julgar a polaridade relativa de uma ligação covalente, os químicos usam a eletronegatividade, que é uma medida relativa de quão fortemente um átomo atrai elétrons quando forma uma ligação covalente. Existem várias escalas numéricas para classificar a eletronegatividade. A Figura 3 mostra uma das escalas mais populares, a Pauling.
Looking Closer: Linus Pauling
Arguivelmente o químico mais influente do século XX, Linus Pauling (1901-94) é a única pessoa a ter ganho dois prémios Nobel individuais (ou seja, não partilhados). Na década de 1930, Pauling usou novas teorias matemáticas para enunciar alguns princípios fundamentais da ligação química. Seu livro de 1939 The Nature of the Chemical Bond é um dos mais significativos livros já publicados em química.
Até 1935, o interesse de Pauling se voltou para as moléculas biológicas, e ele recebeu o Prêmio Nobel de Química de 1954 por seu trabalho sobre estrutura de proteínas. (Ele estava muito perto de descobrir a estrutura de dupla hélice do DNA quando James Watson e James Crick anunciaram sua própria descoberta de sua estrutura em 1953). Mais tarde ele recebeu o Prêmio Nobel da Paz de 1962 por seus esforços para proibir os testes de armas nucleares.

Linus Pauling foi um dos químicos mais influentes do século 20.
Nos seus últimos anos, Pauling ficou convencido de que grandes doses de vitamina C preveniriam doenças, incluindo a constipação comum. A maioria das pesquisas clínicas falhou em mostrar uma conexão, mas Pauling continuou a tomar grandes doses diariamente. Ele morreu em 1994, tendo passado uma vida inteira a estabelecer um legado científico que poucos jamais igualarão.
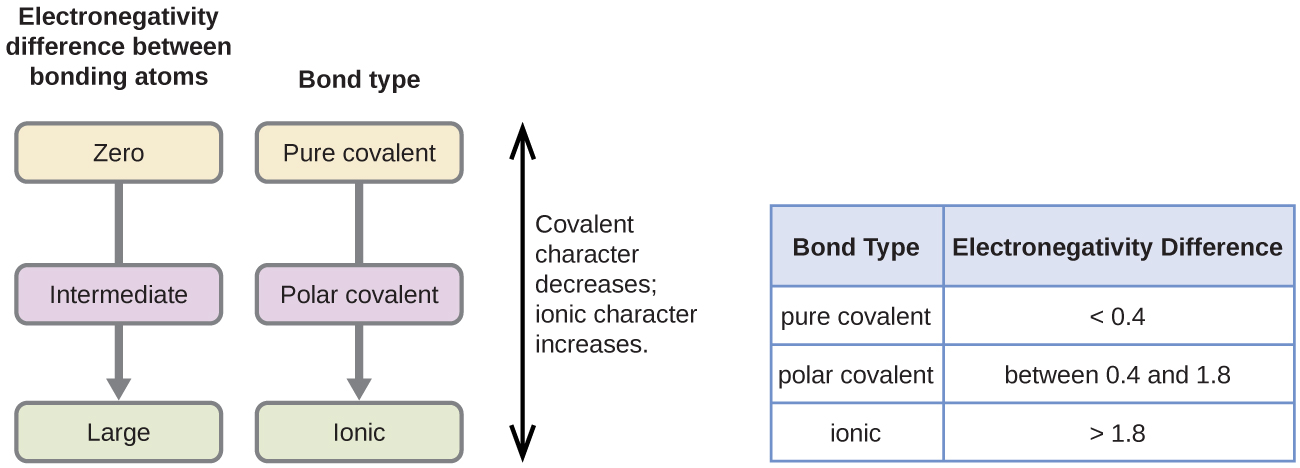
A polaridade de uma ligação covalente pode ser julgada determinando a diferença entre as eletronegatividades dos dois átomos que fazem a ligação. Quanto maior for a diferença nas electronegatividades, maior será o desequilíbrio da partilha dos electrões na ligação. Embora não existam regras rígidas e rápidas, a regra geral é se a diferença nas electronegatividades for inferior a cerca de 0,4, a ligação é considerada não-polar; se a diferença for superior a 0,4, a ligação é considerada polar. Se a diferença nas electronegatividades for suficientemente grande (geralmente maior que cerca de 1,8), o composto resultante é considerado iônico e não covalente. Uma diferença de eletronegatividade de zero, naturalmente, indica uma ligação não polar covalente.
Exemplo \(\PageIndex{1}\)
p>Descreva a diferença de eletronegatividade entre cada par de átomos e a polaridade resultante (ou tipo de ligação).
- C e H
- H e H
- Na e Cl
- O e H
Solução
- Carbono tem uma eletronegatividade de 2,5, enquanto que o valor para o hidrogênio é 2,1. A diferença é de 0,4, o que é bastante pequeno. A ligação C-H é portanto considerada não-polar.
- Ambos os átomos de hidrogênio têm o mesmo valor de eletronegatividade-2,1. A diferença é zero, portanto a ligação é não-polar.
- A electronegatividade do sódio é 0,9, enquanto que a do cloro é 3,0. A diferença é 2,1, que é bastante alta, e assim o sódio e o cloro formam um composto iônico.
- com 2,1 para hidrogênio e 3,5 para oxigênio, a diferença de eletronegatividade é 1,4. Seria de esperar uma ligação muito polar. The sharing of electrons between O and H is unequal with the electrons more strongly drawn towards O.
Exercise \(\PageIndex{1}\)
Describe the electronegativity (EN) difference between each pair of atoms and the resulting polarity (or bond type).
- C and O
- K and Br
- N and N
- Cs and F
Answer a:
The EN difference is 1.0 , hence polar. The sharing of electrons between C and O is unequal with the electrons more strongly drawn towards O.
Answer b:
The EN difference is greater than 1.8, hence ionic.
Answer c:
Identical atoms have zero EN difference, hence nonpolar.
Answer d:
The EN difference is greater than 1.8, hence ionic.