Introdução
A ligação iônica é a transferência completa do(s) elétron(es) de valência entre átomos. É um tipo de ligação química que gera dois íons de carga oposta. Nas ligações iônicas, o metal perde elétrons para se tornar um cátion com carga positiva, enquanto o não-metal aceita esses elétrons para se tornar um ânion com carga negativa. Ligações iônicas requerem um doador de elétrons, muitas vezes um metal, e um aceitador de elétrons, um não-metal.
A ligação iônica é observada porque os metais têm poucos elétrons em suas orbitais mais externas. Ao perder esses elétrons, esses metais podem alcançar uma configuração de gás nobre e satisfazer a regra do octeto. Da mesma forma, os não metais que têm perto de 8 elétrons em suas conchas de valência tendem a aceitar prontamente os elétrons para alcançar a configuração de gás nobre. Na ligação iônica, mais de 1 elétron pode ser doado ou recebido para satisfazer a regra do octeto. As cargas sobre o ânion e catião correspondem ao número de elétrons doados ou recebidos. Em ligações iônicas, a carga líquida do composto deve ser zero.
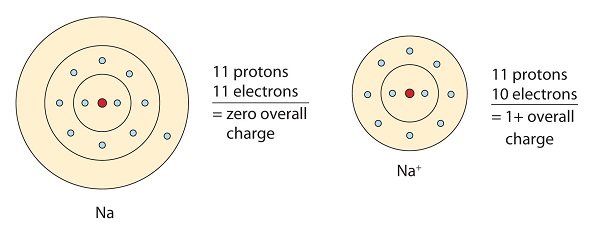
Esta molécula de sódio doa o elétron solitário em sua valência orbital para conseguir a configuração de octeto. Isto cria um cátion carregado positivamente devido à perda de elétron.
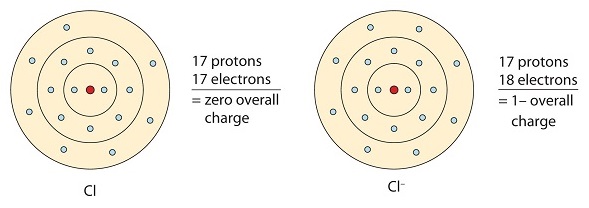
Este átomo de cloro recebe um elétron para alcançar a sua configuração de octeto, o que cria um ânion carregado negativamente.
A energia global prevista do processo de ligação iónica, que inclui a energia de ionização do metal e afinidade dos electrões do não-metal, é geralmente positiva, indicando que a reacção é endotérmica e desfavorável. No entanto, esta reacção é altamente favorável devido à atracção electrostática entre as partículas. Na distância interatômica ideal, a atração entre essas partículas libera energia suficiente para facilitar a reação. A maioria dos compostos iônicos tende a se dissociar em solventes polares, pois eles são muitas vezes polares. Este fenómeno é devido às cargas opostas em cada íon.
Exemplo \(\PageIndex{1}}): Sais de Cloro
.jpg?revision=2)
Neste exemplo, o átomo de sódio está a doar o seu electrão de 1 valência ao átomo de cloro. Isto cria um cátion de sódio e um ânion de cloro. Note que a carga líquida do composto resultante é 0.
.jpg?revision=2)
Neste exemplo, o átomo de magnésio está doando ambos os seus elétrons de valência para os átomos de cloro. Cada átomo de cloro só pode aceitar 1 elétron antes de conseguir sua configuração de gás nobre; portanto, são necessários 2 átomos de cloro para aceitar os 2 elétrons doados pelo magnésio. Notice that the net charge of the compound is 0.