


Tabela de conteúdos
Patofisiologia de PCOS
Critérios de diagnóstico
Resistência à insulina e resistência à leptina
Autores
p>Muitos de nós não percebemos o quão bem funciona o intrincado sistema de loops de feedback em nosso sistema endócrino reprodutivo até que eles sejam perturbados de alguma forma. A síndrome dos ovários policísticos (PCOS) representa um exemplo disso. É um distúrbio caracterizado por uma coleção de sintomas, e é prevalente em pacientes que apresentam em clínicas de infertilidade, afetando 5-10% das mulheres em idade reprodutiva. Estima-se que 90% dos casos anovulatórios estejam relacionados com a PCOS. Além de afetar negativamente os parâmetros metabólicos e a ovulação, também está associada a vários problemas de saúde mental (como depressão e ansiedade) nas mulheres que a têm. Na parte 1, discutiremos a fisiopatologia da PCOS, seus critérios diagnósticos e a resistência à insulina e leptina. Na parte 2, abordaremos o manejo da PCOS, suas implicações psicológicas e o papel único do clínico no apoio ao paciente com PCOS.
Patofisiologia da PCOS
Em mulheres ovulatórias, sob a influência de um eixo hipotálamo-hipófise-ovariano (HPO) em bom funcionamento, o ciclo menstrual é caracterizado pelo crescimento e desenvolvimento de (geralmente) um único folículo que é extraído da coorte desse mês (grupo de folículos). Em resposta à estimulação do GnRH, a hipófise anterior segrega duas gonadotrofinas importantes: Hormônio Estimulante do Folículo (FSH) e Hormônio Luteinizante (LH). A FSH atua no ovário para ajudar no crescimento e amadurecimento de pequenos folículos. O folículo dominante desse mês é aquele que adquiriu a maioria dos receptores FSH. Este folículo continuará a crescer e amadurecer à custa dos folículos pequenos restantes, que depois são reabsorvidos pelo corpo (mas ainda são deduzidos do fornecimento total de óvulos da mulher). O crescimento do folículo dominante gera produção de estradiol e níveis elevados de estrogênio sinalizam a interrupção da produção de FSH através de um sistema de feedback negativo, mas um nível elevado e sustentado de estrogênio desencadeará um surto único de LH, o que faz com que a ovulação ocorra.
Em uma mulher com PCOS o eixo HPO não expressa a funcionalidade normal. O hormônio pulsátil GnRH é alterado, resultando em aumento da atividade do LH pela glândula pituitária. Este aumento no LH aumenta a estimulação celular (ver Figura 1), que produz androstenediona e testosterona, dois andrógenos, e o meio hiperandrogênico resultante do ovário impede o crescimento folicular normal, a maturação e a ovulação. O ovário, então, torna-se composto de muitos folículos pequenos e anormais que nunca se tornam dominantes. A coleção destes folículos pode causar um aumento no tamanho dos ovários e gerar um nível ligeiramente elevado de estrogênio basal sérico. Ainda não se sabe porque ocorre a PCOS e a quem ela afeta, mas pensa-se que a genética e os fatores ambientais têm uma complexa interação na sua emergência e manifestações clínicas.
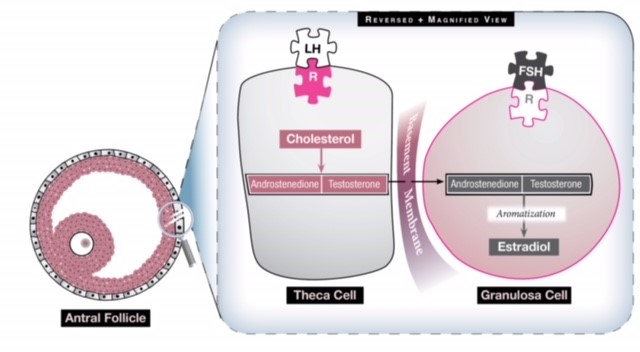
Fig 1: Existem duas células no ovário que contribuem para a produção de estrogênio e que trabalham sinergicamente. A célula theca converte o colesterol em dois andrógenos (androstenediona e testosterona) sob a influência do LH. Estes andrógenos viajam então através da membrana do porão para a célula granulosa que, sob a influência do FSH, os converte em estrogênio através de um processo chamado aromatização. O excesso de estímulo de LH, então, gerará mais andrógenos do que pode ser convertido em estrogênio, de modo que o nível de estrogênio nunca se eleva o suficiente para gerar um surto de LH e o ovário tem um meio hiperandrogênico.
Critérios de diagnóstico
PCOS não é definido ou diagnosticado por um simples sintoma e é frequentemente um diagnóstico de exclusão para mulheres que têm oligo-ovulação e evidência de hiperandrogenismo (como acne alopecia e hirsutismo (crescimento e textura dos cabelos masculinos) uma vez que outros distúrbios são excluídos. Afecta mulheres de todas as formas, tamanhos e origens. Embora os sintomas possam começar na menarca, a maioria dos clínicos relutam em diagnosticar um adolescente relativamente recente com PCOS, já que a irregularidade do ciclo menstrual é normal no primeiro ano pós-menarca e pode se resolver a tempo. Os critérios diagnósticos mais utilizados hoje em dia foram revistos num workshop internacional de especialistas em Roterdão, na Holanda, em 2003 e chamam-se RotterdamCriteria, onde foram estabelecidos os seguintes O PCOS só pode ser diagnosticado quando um paciente tem pelo menos duas de três características: oligo/anovulação, hiperandrogenismo (bioquímico ou clínico), e o aparecimento de ovários policísticos por ultra-som. O hiperandrogenismo é diagnosticado clinicamente (pelo clínico observando sintomas androgênicos) ou bioquimicamente (como níveis elevados de testosterona livre de soro).
Estes critérios foram revistos em 2018 por um comité internacional que fez algumas alterações. Primeiro, devido à disponibilidade de máquinas de ultra-som transvaginal sensível, a policlimorfologia dos ovários (PCOM) é caracterizada pela presença de 20 ou mais folículos (<10 mm) no ovário ou em um volume ovariano ≥ 10 ml em qualquer ovário como visto pela ultra-sonografia transvaginal, muitas vezes situado ao redor da periferia do ovário (ou ovários). As diretrizes de 2018 também afirmam que se uma mulher tem ciclos menstruais irregulares e hiperandrogenismo que a ultra-sonografia não é necessária para o diagnóstico, embora muitos clínicos ainda prefiram realizar esta ultra-sonografia. Os níveis de Hormônio Anti-Mulleriano (HMA) são freqüentemente elevados em pacientes com PCOS, embora isso não seja específico para PCOS, pois níveis elevados podem ser encontrados em mulheres sem a condição. Em mulheres com PCOS, um nível elevado de HMA é reflexo de um maior número de folículos testados nos estágios pré-antral e antral que não conseguem ovular.
Outras condições que podem causar ciclos menstruais irregulares (gravidez, hipo e hipertireoidismo, falha ovariana e hiperprolactinemia) e hiperandrogenismo (hiperplasia congênitaadrenal, tumor adrenal e tumor secretor de andrógeno) devem ser descartados em primeiro lugar, Assim, além dos níveis séricos de bHCG, os níveis basais de FSH e LH, a hormona estimulante da tireóide (TSH), prolactina, testosterona total e livre, 17hidroxiprogesterona (17OHP), sulfato de desidroepiandrosterona (DHEAS) são extraídos. Um dos diagnósticos diferenciais mais difíceis é o de uma mulher com amenorréia funcionalhipotalâmica (FHA) versus uma mulher magra com PCOS. Classicamente as mulheres com FHA têm baixo IMC, mas também pode estar na faixa baixa/normal. Ambas as condições são caracterizadas pela anovulação e os ovários que parecem ter muitos folículos pequenos em estado de repouso. Embora o hiperandrogenismo não seja acomponente da FHA, as mulheres com a condição podem ter hirsutismo devido à sua etnia, confundindo ainda mais o quadro clínico. Uma forma de distinguir a FHA da PCOS é através de testes de sangue e exames ultra-sonográficos. As mulheres com FHA têm frequentemente níveis basais de FSH e LH baixos a normais (devido à hipoestimulação dos ovários) e um baixo nível de estrogénio, enquanto que as mulheres com PCOS têm níveis séricos elevados de LH e níveis de FSH baixos a normais. Na ultra-sonografia, o útero e ovários de mulheres com FHA são pequenos ou pequenos/normal, enquanto mulheres com PCOS tipicamente têm um volumeovariano aumentado (>10 ml). Há pesquisas emergentes sobre uma possível conexão entre ambos FHA e PCOS já que nem todas as mulheres apresentam características características de ambas as condições e FHA e PCOS têm algumas características sobrepostas.
Resistência à insulina e resistência à leptina
Embora o diagnóstico de resistência à insulina (IR) não faça parte dos Critérios de Roterdã, ela é altamente prevalente em mulheres com PCOS. Um IMC elevado aumenta a chance de uma mulher com PCOS ter IR, mas mesmo mulheres não obesas com PCOS são muito mais propensas a desenvolver resistência insulínica do que suas contrapartes sem PCOS. Além das conseqüências à saúde da IR (como a síndrome metabólica e diabetes mellitus tipo 2), também exacerba e contribui para o hiperandrogenismo em uma população de pacientes que já sofre com ela.
O padrão ouro para o diagnóstico da resistência à insulina é o uso de uma pinça hiperinsulinêmica euglicêmica, no máximo, que deve ser realizada em ambiente hospitalar. Para a maioria das pessoas, isto não é razoável, portanto o teste indireto de IR é feito. Em mulheres com PCOS em ambiente clínico de apreconcepção, a sugestão é fazer um teste de tolerância à glicose oral (OGTT) dado o alto risco de mulheres com PCOS desenvolverem tolerância à glicose prejudicada e diabetes gestacional na gravidez. Apesar de consumir um pouco de tempo, esse exame é preferível ao jejum da glicose plasmática e dos níveis de insulina por si só, uma vez que pode diagnosticar a deficiência da tolerância à glicose em um estágio mais precoce, IMC<25 kg/m2,não tentando conceber, sem histórico pessoal ou familiar de comprometimento da tolerância à glicose) obtendo pelo menos os níveis de glicose, insulina e hemoglobinA1c em jejum basal podem ser úteis para se obter uma “foto” do estado glicêmico daquele paciente.
Quando uma mulher tem PCOS, estar acima do peso ou ser obesa intensifica as consequências metabólicas. As células brancas de gordura são metabolicamente activas. A um nível normal, são protectores, pois proporcionam uma casa segura para os lípidos e mantêm a gordura fora dos órgãos. Quando há demasiadas células gordas, podem ficar sobrecarregadas e rebentar, libertando ácidos gordos na corrente sanguínea que podem afectar todos os órgãos. Estas células adiposas ficam “presas” entre as células dos órgãos e fazem com que fiquem rígidas, danificadas, menos funcionais e causam inflamação crónica. Não é raro diagnosticar “fígado gordo” numa mulher com PCOS que é obesa, uma vez que o fígado é particularmente vulnerável. Além disso, um excesso de adiposidade pode perpetuar a hiperinsulinemia e a resistência à insulina existentes, perturbando o equilíbrio delicado das citocinas e hormonas produzidas pelo tecido adiposo (ver Figura 2), por exemplo, diminuindo a produção de citocinas que aumentam a sensibilidade à insulina e aumentando as que promovem a inflamação e a resistência à insulina. O excesso de insulina contribui ainda mais para a adiposidade abdominal e o hiperandrogenismo, criando um ciclo vicioso em pacientes com PCOS que pode ser difícil de superar.
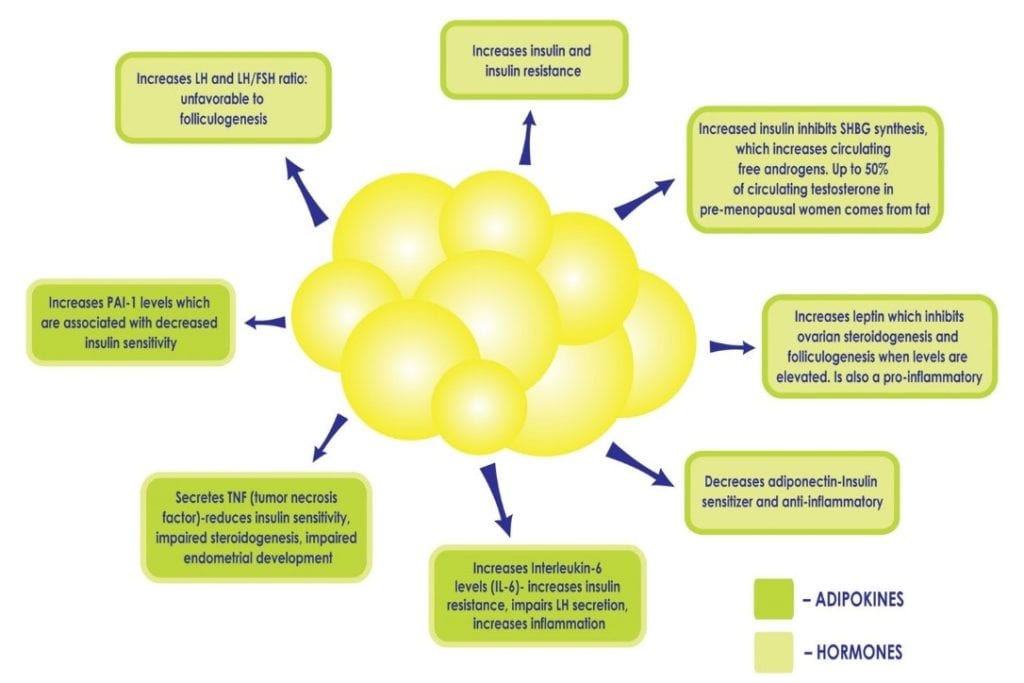
Figure 2: O aumento da adiposidade, e o subsequente aumento das células adiposas, pode perpetuar a hiperinsulinemia e a resistência à insulina, perturbando o delicado equilíbrio das hormonas produzidas pelo tecido adiposo, tais como a diminuição da produção de adiponectina, uma citocina que aumenta a sensibilidade insulínica e aumenta outras que promovem a inflamação.
Além da resistência à insulina, pacientes com PCOS e obesidade também podem sofrer do que algum termo resistência à leptina. Alguns estudos têm mostrado que os níveis de leptina são mais altos em pacientes com PCOS obesidade do que em pacientes magros. A leptina é uma proteína produzida pelo tecido adiposo que regula o equilíbrio energético e o apetite do organismo. Quando funciona corretamente, um aumento na leptina sinaliza ao cérebro para reduzir o apetite de uma pessoa e uma diminuição na leptina faz o contrário, sinaliza ao cérebro para aumentar o apetite para fornecer o combustível necessário para a energia. Em muitos pacientes PCOS com obesidade, no entanto, este sistema é defeituoso e, apesar do aumento das concentrações de leptina secundária ao aumento do tecido adiposo, a eficácia da leptina diminui, levando à resistência à leptina. A resistência à leptina é considerada um importante fator de risco para a patogênese do excesso de peso e obesidade, pois o organismo permanece insensível a níveis elevados e sinaliza para a mulher que ela ainda está com fome/não está saciada mesmo depois de comer. Muitas mulheres com PCOS queixam-se de “nunca se sentirem cheias” devido a esta resistência e continuam a comer, levando a um aumento do tecido adiposo, o que resulta num aumento da resistência à leptina e perpetua este ciclo prejudicial. Como resultado, as condições de sobrepeso e obesidade são comuns em mulheres com PCOS e a perda de peso pode parecer impossível, uma vez que a alimentação intuitiva não é eficaz quando os sinais de fome e saciedade não são confiáveis.
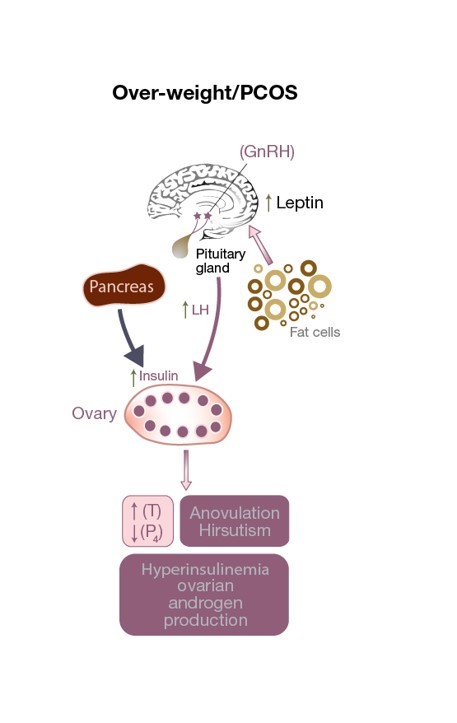
Figure 3: Perturbação do eixo HPO em uma paciente com PCOS. Há excesso de estimulação do LH na célula aca resultando em um aumento dos níveis de testosterona, um ambiente androgênico ovariano, e anovulação (resultando em baixos níveis de progesterona). O aumento dos níveis de leptina devido a um excesso de células adiposas afeta a secreção de GnRH. Os níveis elevados de insulina contribuem para o hiperandrogenismo.
A secreção de leptina não só afecta o peso corporal como pode ter um efeito prejudicial na ovulação (ver Fig 3)e até mesmo na fertilização em pacientes com PCOS de peso normal. Ela altera a liberação de GnRH do hipotálamo, diminuindo a estimulação da hipófise anterior (e portanto a secreção de FSH e LH) e impedindo o desenvolvimento de um oócito maduro. Além disso, as granulosacélulas também armazenam e produzem leptina, e altos níveis de leptindecredução diminuem sua capacidade de aromatização, o que acaba interferindo na capacidade de um dominófilo de produzir quantidades adequadas de estrogênio (ver Figura 1). Um pequeno estudo observacional encontrou uma correlação direta entre a concentração de leptina encontrada no fluido folicular (FF-leptina) (que tem sido correlacionada com a fertilização) em mulheres magras com PCOS que foram submetidas à FIV quando comparadas a mulheres normalmenteovulantes e com peso compatível.
Autores
Jaclyn Carr, BSN
Brianna Giannotte, BSN
Monica Moore, MSN, RNC
p>Especial agradecimento a NeilChappell, MD pela sua assistência na edição deste artigo.
You can visit the FertilityNurse Newsletter website here
Want to be notified about upcoming Fertility Newsletter posts here at The ObG Project?
Get the ObG Insider e-Newsletter ”



![]()