1. Erk signaling overview
O caminho extracelular de sinalização cinase (ERK) é um dos maiores cassetes de sinalização do caminho de sinalização da proteína cinase ativada mitogênica (MAPK). A cascata ERK é ativada por uma variedade de agentes extracelulares, incluindo fatores de crescimento, hormônios e também estresse celular para induzir processos celulares que incluem principalmente a proliferação e diferenciação, mas sob algumas condições também a resposta ao estresse e outras. Os principais componentes MAPK/ERK kinase kinase (MEKK) são os membros da família Raf Raf-1, A-Raf e B-Raf que fosforilam dois resíduos serínicos nos componentes MAPK/ERK kinase (MEK) MEK1/2. Os ERK1/2 são responsáveis pela estimulação dos efectores a jusante, muitos dos quais são factores de transcrição. Um dos principais factores de transcrição é a proteína aglutinante de resposta cíclica AMP (CREB).
Esta via ERK contribui para o controle de um grande número de processos celulares:
– Regulação da proliferação celular como a ativação de células T
– Plasticidade sináptica como a longaPotenciação a termo (LTP) em neurônios hipocampais
– Proliferação de células endoteliais durante a angiogênese
– Fosforilação do fator de transcrição p53
– Remodelação da via de sinalização ERK pode contribuir para o desenvolvimento de doença renal policística
– Ativação da fosfolipase A2 (PLA2) em mastócitos.
2. Cascata de sinalização Erk
A ativação da cascata ERK1/2 é iniciada principalmente nos receptores de membrana, tais como receptores Tyr kinases (RTKs), receptores G acoplados à proteína (GPCRs), canais de íons, e outros. Estes receptores transmitem o sinal recrutando proteínas adaptadoras (por exemplo, Grb2) e fatores de troca (por exemplo, SOS) que, por sua vez, induzem a ativação de Ras nas membranas plasmáticas, ou membranas de outras organelas. O GTP ativado, ligado a Ras, transmite o sinal ativando as proteínas kinases Raf-1, B-Raf, e A-Raf (Rafs) dentro do nível MAP3K desta cascata. Esta ativação ocorre através do recrutamento de Rafs para as membranas, onde elas são então fosforiladas e ativadas. O MOS é outro MAP3K da cascata ERK, mas funciona principalmente no sistema reprodutivo através de um modo de regulação distinto. A partir do nível MAP3K, o sinal é então transmitido para baixo da cascata através dos componentes MAPKK: MEK1/2. Eles são ativados através da fosforilação serina no MAPKK-tipo Ser-Xaa-Ala-Xaa-Ser/Thr motif em seu laço de ativação. Por sua vez, o MEK1/2 ativa seus únicos substratos conhecidos, o ERK1/2 nativo, que funcionam como seus únicos alvos a jusante, sugerindo que o MEK1/2 serve como os componentes determinantes da especificidade da cascata ERK1/2. Os MEK1/2 são as únicas quinases proteicas de dupla especificidade que podem fosforilatar tanto os resíduos reguladores Thr como os resíduos Tyr do ERK1/2. Cerca de 200 substratos distintos do ERK1/2 foram identificados até à data. Eles são substratos ou no citosol (por exemplo, PLA2 RSK), ou na translocação, no núcleo, incluindo fatores de transcrição como Elk1, c-Fos, e c-Jun.
p>- MAP3K-Raf 1
Raf-1 é o melhor estudado das moléculas de sinalização do fator de crescimento ao nível MAP3K da cascata. É uma proteína serina/terreonina quinase de 70- a 75-kDa, que contém um domínio quinase na metade terminal COOH da molécula e um domínio regulador que ocupa o restante. Na estimulação com vários mitógenos, o Raf-1 sofre uma ativação transitória dentro de 2-3 mm. O mecanismo de ativação do Raf-1 tem sido estudado extensivamente ao longo dos últimos anos. Agora está claro que o Raf-1 está localizado abaixo do HAS, que parece interagir diretamente com a porção terminal do NH2- Raf-1 na estimulação.
– MAPKK-MEK1/2
Os MEKs constituem uma família evolutiva conservada de proteína serina/terreonina kinases que até hoje inclui três isoformas altamente homólogas (85%) de mamíferos. O mecanismo de ativação do MEK-1 envolve fosforilação proteica apenas em resíduos de serina e parece ser semelhante quer fosforilação pelo MEKK, Raf-1, quer por fosforilação automática, conforme determinado pelos mapas de fosfopéptidos. Os MAPKKs (MEKs) são altamente específicos para os componentes a jusante ERK-1 e ERK-2. Além disso, MAPKK não reconheceu a forma desnaturada de seu substrato ou peptídeos contendo os sítios de fosforilação nas ERK, indicando que a enzima requer a forma nativa de MAPK.
p>- MAPK-ERK-1/2
Por causa de seu alto grau de similaridade, as ERK-1 e ERK-2 são geralmente consideradas funcionalmente redundantes. O principal mecanismo a montante que leva à fosforilação da ERK-1 e -2 em ambos os resíduos regulamentares é a sua fosforilação por MEK. Devido à natureza bastante ampla do seu reconhecimento do substrato, as ERK podem fosforilatar um grande número de proteínas após a sua activação. Estas proteínas são frequentemente reguladoras na natureza e estão localizadas tanto no citoplasma quanto no núcleo.
3. Sinalização a jusante da via Erk
– Proliferação celular
Fosforilatos ERK1/2 ativados RSK e ambos RSK e ERK translocam para o núcleo onde ativam múltiplos fatores de transcrição como CREB, Fos e Elk-1, resultando em última instância na síntese protéica efetora e causando mudanças na proliferação e sobrevivência celular. CREB (cAMP response element-binding protein) é um fator de transcrição celular que pode melhorar a transcrição genética por mais de 10 vezes. c-fos é uma proteína de 380 aminoácidos com uma região de zipper leucina básica para dimerização e ligação de DNA e um domínio de transativação no C-terminus. Ele está envolvido em eventos celulares importantes, incluindo proliferação celular, diferenciação e sobrevivência; a proteína contendo domínio ETS (Elk-1) é uma proteína que em humanos é codificada pelo gene ELK1. As funções de Elk-1 é também como ativador de transcrição.
– Oncogênese
ativação de ERK1/2 promove metaplasia e desenvolvimento tumoral pela fosforilação de Bim e Bid e causando a degradação proteasômica de Bim e o seqüestro de Bad para as proteínas de ligação fosfoserina e, assim, inibindo a apoptose. Em um caminho separado, os fosforilatos de ativação ERK1/2 FOXO3a em Ser 294, Ser 344 e Ser 425 e facilita a interação FOXO3a-MDM2. Esta interação melhora a degradação do FOXO3a através de uma via ubiquitina-protease dependente de MDM2, levando ao desenvolvimento do tumor.
– Desenvolvimento e diferenciação
Sinalização por receptores de tirosina kinases que ativam a via Ras/Raf/MAP kinase regula o desenvolvimento e diferenciação de muitos tipos de células. Principalmente através da ativação dos transdutores de sinal e ativadores das proteínas de transcrição (STATs).
– Ciclo celular
Cdc25 ativa as kinases dependentes de ciclina, removendo o fosfato dos resíduos no local ativo do Cdk. É conhecido por controlar as transições da fase G1 para a fase S e G2 para a fase M. Erk1/2 pode ativar a proteína Cdc25 e por sua vez promover a progressão do ciclo celular.
4. Regulação da sinalização Erk
A regulação da sinalização Erk é muito importante para que possamos manter a função normal das células. Existem múltiplas estratégias de regulação da célula para regular a via de sinalização de Erk, incluindo principalmente regulação por laços de retroalimentação, por andaimes de fluxo ascendente e descendente, por fosfatase e inibidores da via de sinalização de Erk.
– Regulação de laços de retroalimentação
Existem vários pontos de retroalimentação negativa na via ERK (Figura 1). MEK é um alvo e pode ser inibido pela fosforilação ERK do MEK1/2 no Thr292 e no Thr212. A fosforilação impede o aumento da atividade do MEK pelo PAK1 e, portanto, reduz a ativação do ERK. A fosforilação do Raf em vários locais pelo ERK fornece um segundo mecanismo de circuito de feedback possível. A hiperfosforilação destes locais impede a interação do Raf com a Ras GTPase e promove sua desfosforilação pela fosfatase PP2A. A ativação ou upregulação transcripcional das fosfatases pela ERK é um mecanismo alternativo de retroalimentação negativa. Estes vários circuitos de retroalimentação negativa ativados pelo ERK fornecem um meio para limitar a duração do sinal e retornar o caminho para o estado basal.
– Regulação de andaimes de fluxo ascendente e descendente
Proteínas do andaime ligam dois ou mais componentes de um caminho de sinalização para aproximá-los e assim facilitar a sua interação funcional. Além disso, os andaimes podem direcionar esses módulos de sinalização multi-enzimática para diferentes localizações celulares e assim melhorar a fosforilação de um subconjunto específico de substratos para baixo. Os andaimes também afetam a duração do sinal, previnem o crosstalk entre vias semelhantes e podem ligar a ativação do módulo de sinalização a um sinal específico de ativação a montante.
– Fosfatase e Inibidores
A atividade das vias MAPK é determinada pelas ações concorrentes das kinases a montante e das fosfatases inibitórias. As vias MAPK são terminadas pela desfosforização dos seus componentes por várias fosfátases. Várias fosfatases serinas/treoninas, como PP2A e PP2Ca, e fosfatases tirosinas, como PTP-SL e HePTP, demonstraram inactivar MAPKs.
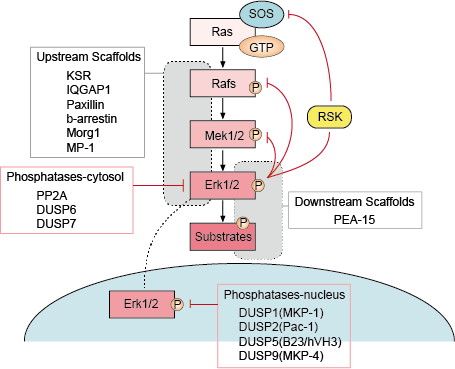
p>Figure 1. Regulação da via de sinalização de Erk
5. Relação com as doenças
Consistente com seus papéis críticos em atividades celulares chave, incluindo proliferação celular, diferenciação e sobrevivência ou morte, as vias de sinalização MAPK têm sido implicadas na patogênese de muitas doenças humanas.
– Doença de Alzheimer
Doença de Alzheimer (DA) é uma doença neurodegenerativa caracterizada por disfunção cognitiva e de memória que se pensa resultar da formação no cérebro tanto de placas senis contendo amilóide-β (Aβ) como de emaranhados neurofibrilares contendo o tau proteico associado ao microtubo. Evidências sugerem que as vias de sinalização MAPK podem contribuir para a patogênese da DA através da regulação da apoptose neuronal, β- e γ-atividade secretase, e fosforilação da APP e tau.
– Doença de Parkinson
Doença de Parkinson (DP) é a segunda doença neurodegenerativa mais prevalente. Várias observações sugerem que as vias de sinalização MAPK contribuem para respostas neuroinflamatórias e morte neuronal desencadeada por agregados de sinucleína α ou deficiências funcionais em parkin ou DJ-1 na patogênese da doença de Parkinson.
– Sinalização MAPK no câncer
Muitas das mutações associadas ao câncer de componentes das vias de sinalização MAPK foram encontradas em Ras e B-Raf, ambas participando da via de sinalização ERK. A via de sinalização ERK desempenha um papel em várias etapas do desenvolvimento do tumor. A fosforilação por ERK de proteínas como a miosina cinase da cadeia leve, calpaina, cinase de adesão focal e paxilina promove a migração das células cancerosas. Além disso, a sinalização ERK1/2 regula as atividades e níveis das proteínas da família Bcl-2, como a proteína pró-apoptótica BIM e a proteína anti-apoptótica MCL-1, promovendo assim a sobrevivência das células cancerígenas.
| Keshet Y, Seger R. The MAP kinase signaling cascades: a system of hundreds of components regulates a diverse array of physiological functions. MAP Kinase Signaling Protocols: Second Edition, 2010: 3-38. | |
| Wortzel I, Seger R. The ERK cascade distinct functions within various subcellular organelles. Genes & cancer, 2011, 2(3): 195-209. | |
| Ramos J W. The regulation of extracellular signal-regulated kinase (ERK) in mammalian cells. The international journal of biochemistry & cell biology, 2008, 40(12): 2707-2719. | |
| Shaul Y D, Seger R. The MEK/ERK cascade: from signaling specificity to diverse functions. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2007, 1773(8): 1213-1226. | |
| Yao Z, Seger R. The ERK signaling cascade—views from different subcellular compartments. Biofactors, 2009, 35(5): 407-416. |