Formale Ladungen
Organische Moleküle können auch positive oder negative Ladungen haben. Bei chemischen Reaktionen ist es üblich, dass Reaktionspartner, Zwischenprodukte und/oder Produkte geladen sind. Das Erkennen und Unterscheiden zwischen neutralen und geladenen Bindungsmustern ist hilfreich beim Erlernen von Reaktionsmechanismen. Betrachten Sie die Lewis-Struktur von Methanol, CH3OH (Methanol ist der so genannte „Holzalkohol“, den skrupellose Schmuggler während der Prohibition in den 1920er Jahren manchmal verkauften und der die Menschen, die ihn tranken, oft blind machte). Methanol selbst ist ein neutrales Molekül, kann aber ein Proton verlieren, um ein molekulares Anion (CH3O-) zu werden, oder ein Proton gewinnen, um ein molekulares Kation (CH3OH2+) zu werden.

Das molekulare Anion und das molekulare Kation haben eine Gesamtladung von -1 bzw. +1. Wir können aber noch genauer sein und für jedes Molekülion angeben, dass sich eine formale Ladung speziell am Sauerstoffatom und nicht am Kohlenstoff- oder einem der Wasserstoffatome befindet.
Die formale Ladung der verschiedenen Atome eines Moleküls zu bestimmen, ist ein unkomplizierter Prozess – es geht einfach darum, die Valenzelektronen zu addieren.
Ein ungebundenes Sauerstoffatom hat 6 Valenzelektronen. Wenn es jedoch als Teil eines Methanolmoleküls gebunden ist, ist ein Sauerstoffatom von 8 Valenzelektronen umgeben: 4 nicht bindende Elektronen (zwei „einsame Paare“) und 2 Elektronen in jeder der beiden kovalenten Bindungen (eine zum Kohlenstoff, eine zum Wasserstoff). In der formalen Ladungskonvention sagen wir, dass der Sauerstoff alle 4 nicht bindenden Elektronen „besitzt“. Es „besitzt“ jedoch nur ein Elektron aus jeder der beiden kovalenten Bindungen, da bei kovalenten Bindungen die Elektronen zwischen den Atomen geteilt werden. Daher besitzt das Sauerstoffatom in Methanol 2 + 2 + (½ x 4) = 6 Valenzelektronen.
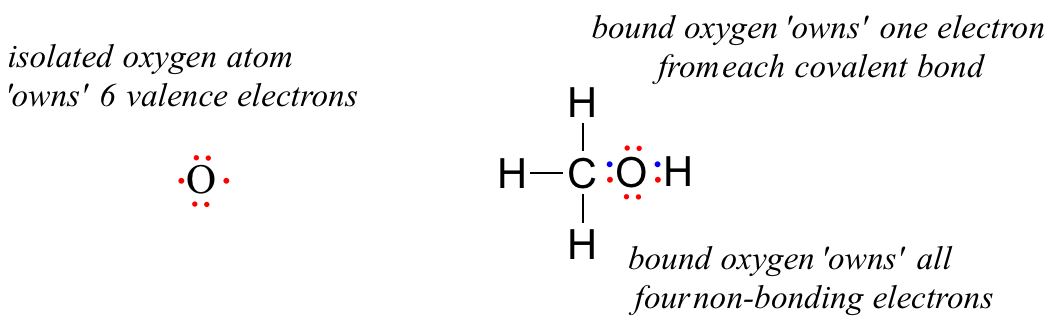
The formal charge on an atom is calculated as the number of valence electrons owned by the isolated atom minus the number of valence electrons owned by the bound atom in the molecule:
Determining formal charge on an atom
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of valence electrons owned by the bound atom)
or . . .
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of non-bonding electrons on the bound atom)
– ( ½ the number of bonding electrons on the bound atom)
Using this formula for the oxygen atom of methanol, we have:
formal charge on oxygen =
(6 valence electrons on isolated atom)
– (4 non-bonding electrons)
– (½ x 4 bonding electrons)
= 6 – 4 – 2 = 0. Thus, oxygen in methanol has a formal charge of zero (in other words, it has no formal charge).
How about the carbon atom in methanol? An isolated carbon owns 4 valence electrons. The bound carbon in methanol owns (½ x 8) = 4 valence electrons:
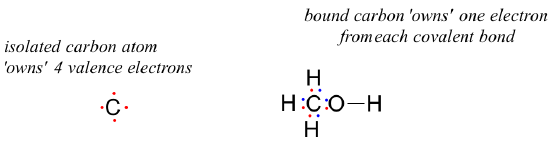
formal charge on carbon =
(4 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 8 bonding electrons)
= 4 – 0 – 4 = 0. So the formal charge on carbon is zero.
For each of the hydrogens in methanol, we also get a formal charge of zero:
formal charge on hydrogen =
(1 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 2 bonding electrons)
= 1 – 0 – 1 = 0
Now, let’s look at the cationic form of methanol, CH3OH2+. The bonding picture has not changed for carbon or for any of the hydrogen atoms, so we will focus on the oxygen atom.
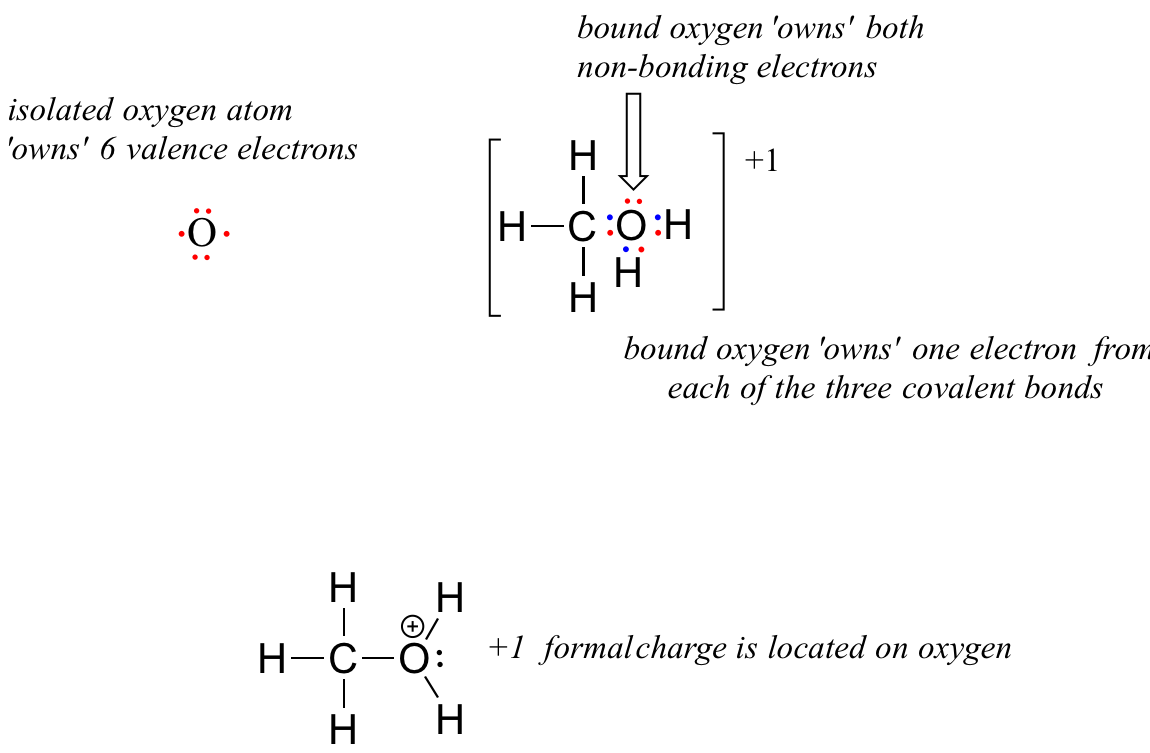
The oxygen owns 2 non-bonding electrons and 3 bonding elections, so the formal charge calculations becomes:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (2 non-bonding electrons)
– (½ x 6 bonding electrons)
= 6 – 2 – 3 = 1. A formal charge of +1 is located on the oxygen atom.
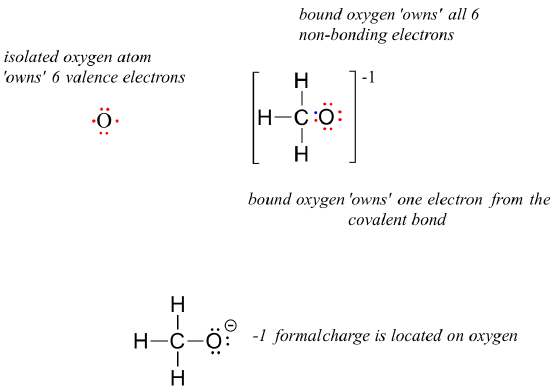
For methoxide, the anionic form of methanol, the calculation for the oxygen atom is:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (6 non-bonding electrons)
– (½ x 2 bonding electrons)
= 6 – 6 – 1 = -1. A formal charge of -1 is located on the oxygen atom.
A very important rule to keep in mind is that the sum of the formal charges on all atoms of a molecule must equal the net charge on the whole molecule.
Beim Zeichnen der Strukturen organischer Moleküle ist es sehr wichtig, alle von Null verschiedenen formalen Ladungen darzustellen, wobei klar sein muss, wo sich die Ladungen befinden. Eine Struktur, bei der die formalen Ladungen ungleich Null sind, ist nicht korrekt gezeichnet und wird in der Prüfung wahrscheinlich als solche bewertet!
Wenn du jetzt an das denkst, was du in der allgemeinen Chemie gelernt hast, fragst du dich wahrscheinlich: „Was ist mit Dipolen? Besitzt ein Sauerstoffatom in einer O-H-Bindung nicht mehr Elektronendichte als der Wasserstoff, weil es eine höhere Elektronegativität hat?“ Das ist absolut richtig, und wir werden das Konzept der Bindungsdipole später noch genauer betrachten. Für die Berechnung der formalen Ladungen spielen die Bindungsdipole jedoch keine Rolle – wir gehen immer davon aus, dass die beiden Elektronen in einer Bindung gleichmäßig verteilt sind, auch wenn dies nicht der chemischen Realität entspricht. Formale Ladungen sind genau das – eine Formalität, eine Methode der Elektronenbuchführung, die in das Lewis-System zum Zeichnen der Strukturen von organischen Verbindungen und Ionen eingebunden ist. Später werden wir sehen, wie das Konzept der formalen Ladung uns helfen kann, die Reaktion organischer Moleküle zu visualisieren.
Schließlich sollte man sich nicht zu der Annahme verleiten lassen, dass es keine Atome mit formalen Ladungen gibt, nur weil die Nettoladung einer Struktur null ist: Ein Atom könnte eine positive formale Ladung und ein anderes eine negative formale Ladung haben, und die Nettoladung wäre immer noch null. Zwitterionen, wie z.B. Aminosäuren, haben sowohl positive als auch negative formale Ladungen an verschiedenen Atomen:

Auch wenn die Nettoladung von Glycin gleich Null ist, ist es dennoch notwendig, die Lage der positiven und negativen formalen Ladungen darzustellen.
Übung 1.4
Ergänzen Sie alle fehlenden einsamen Elektronenpaare und formalen Ladungen in den untenstehenden Strukturen. Gehen Sie davon aus, dass alle Atome eine vollständige Valenzschale mit Elektronen haben. Die Nettoladungen sind außerhalb der Klammern angegeben.
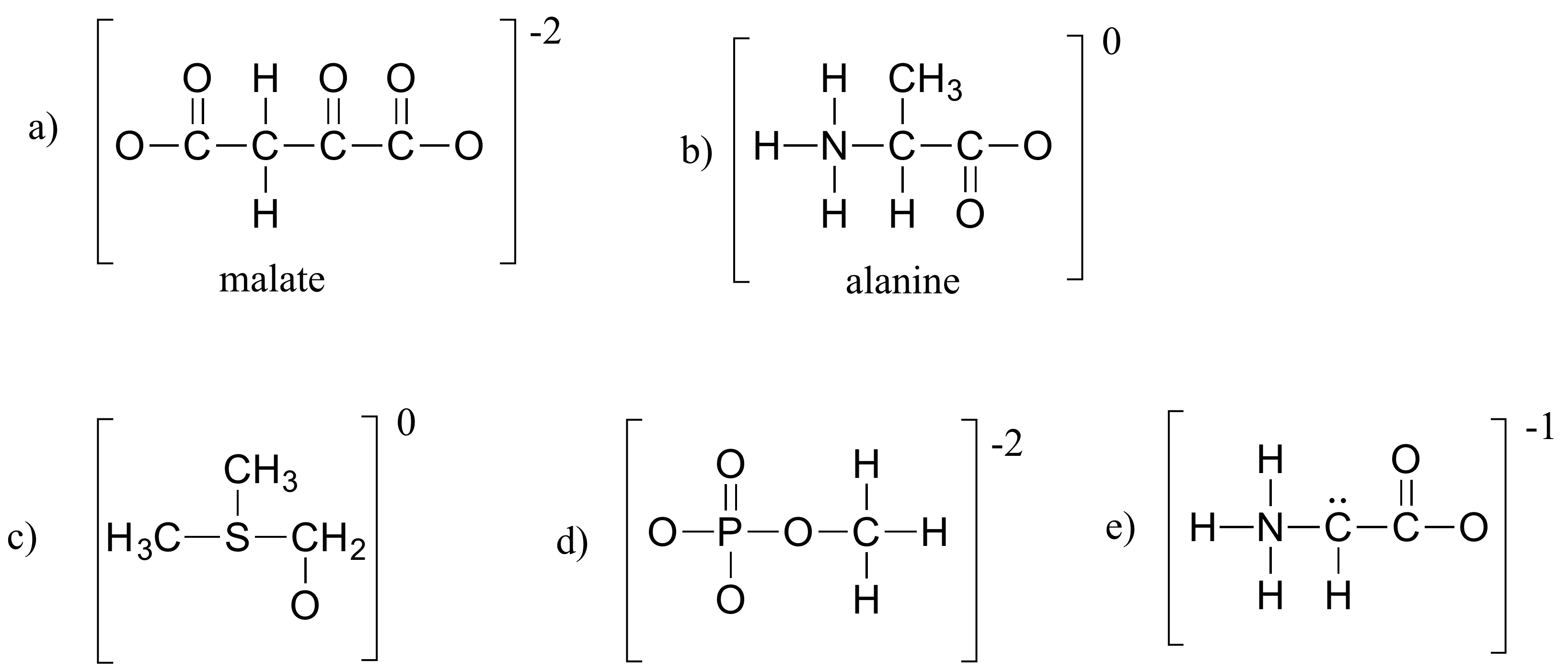
Lösungen zu den Übungen