Elektronegativität und Bindungspolarität
Obwohl wir kovalente Bindungen als Elektronenverteilung definiert haben, werden die Elektronen in einer kovalenten Bindung nicht immer gleichmäßig von den beiden gebundenen Atomen verteilt. Es sei denn, die Bindung verbindet zwei Atome desselben Elements, wie bei H2, dann gibt es immer ein Atom, das die Elektronen in der Bindung stärker anzieht als das andere Atom, wie bei HCl, das in Abbildung \(\PageIndex{1}\) dargestellt ist. Eine kovalente Bindung, bei der die Elektronen gleichmäßig verteilt sind (Abbildung \(\PageIndex{1a}\)), nennt man eine unpolare kovalente Bindung. Eine kovalente Bindung, bei der die Elektronen ungleich verteilt sind, wie in Abbildung \(\PageIndex{1b}\), wird als polare kovalente Bindung bezeichnet.

Die Verteilung der Elektronendichte in einer polaren Bindung ist ungleichmäßig. Sie ist um das Atom, das die Elektronen mehr anzieht, größer als um das andere. Zum Beispiel halten sich die Elektronen in der H-Cl-Bindung eines Chlorwasserstoffmoleküls mehr in der Nähe des Chloratoms als in der Nähe des Wasserstoffatoms auf. Beachten Sie, dass der schattierte Bereich um Cl in Abbildung \(\PageIndex{1b}\) viel größer ist als um H.
Dieses Ungleichgewicht in der Elektronendichte führt zu einer partiellen negativen Ladung (bezeichnet als δ-) auf einer Seite der Bindung (Cl) und einer partiellen positiven Ladung (bezeichnet als δ+) auf der anderen Seite der Bindung (H). Dies ist in Abbildung \(\PageIndex{2a}\) zu sehen. Die Ladungstrennung in einer polaren kovalenten Bindung führt zu einem elektrischen Dipol (zwei Pole), dargestellt durch den Pfeil in Abbildung \(\PageIndex{2b}\). Die Richtung des Pfeils zeigt zum δ- Ende, während das + Ende des Pfeils das δ+ Ende der Bindung anzeigt.
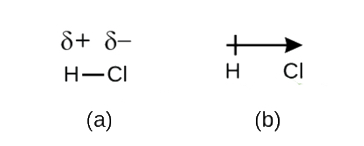
Abbildung \(\PageIndex{2}\): (a) Die ungleiche Aufteilung des Bindungselektronenpaares zwischen H und Cl führt zu einer teilweisen positiven Ladung des H-Atoms und einer teilweisen negativen Ladung des Cl-Atoms. Die Symbole δ+ und δ- zeigen die Polarität der H-Cl-Bindung an. (b) Der Dipol wird durch einen Pfeil mit einem Kreuz am Ende dargestellt. Das Kreuz befindet sich in der Nähe des δ+-Endes und die Pfeilspitze fällt mit dem δ- zusammen.
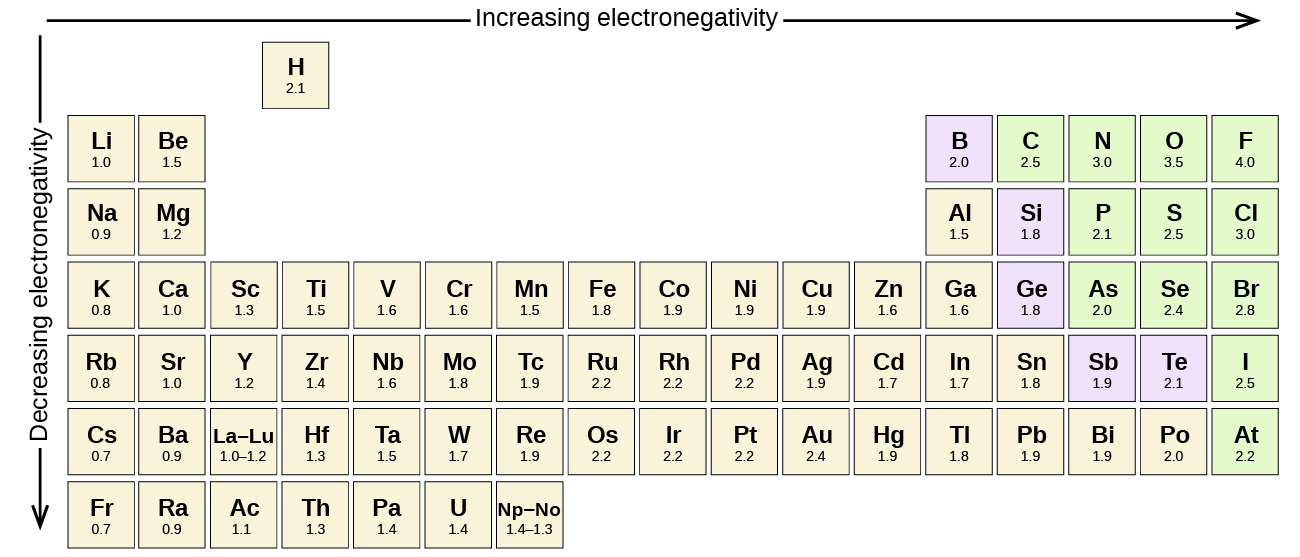
Jede kovalente Bindung zwischen Atomen verschiedener Elemente ist eine polare Bindung, aber der Grad der Polarität ist sehr unterschiedlich. Einige Bindungen zwischen verschiedenen Elementen sind nur geringfügig polar, während andere stark polar sind. Ionische Bindungen können als das Nonplusultra der Polarität angesehen werden, da hier die Elektronen übertragen und nicht geteilt werden. Um die relative Polarität einer kovalenten Bindung zu beurteilen, verwenden Chemiker die Elektronegativität, die ein relatives Maß dafür ist, wie stark ein Atom Elektronen anzieht, wenn es eine kovalente Bindung eingeht. Es gibt verschiedene numerische Skalen zur Bewertung der Elektronegativität. Abbildung \(\PageIndex{3}\) zeigt eine der bekanntesten – die Pauling-Skala.
Näher heran: Linus Pauling
Der wohl einflussreichste Chemiker des 20. Jahrhunderts, Linus Pauling (1901-94), ist die einzige Person, die zwei individuelle (d.h. nicht geteilte) Nobelpreise erhalten hat. In den 1930er Jahren nutzte Pauling neue mathematische Theorien, um einige grundlegende Prinzipien der chemischen Bindung darzulegen. Sein 1939 erschienenes Buch The Nature of the Chemical Bond ist eines der bedeutendsten Bücher, die jemals in der Chemie veröffentlicht wurden.
Ab 1935 wandte sich Paulings Interesse biologischen Molekülen zu, und er erhielt 1954 den Nobelpreis für Chemie für seine Arbeit über die Proteinstruktur. (Er stand kurz davor, die Doppelhelixstruktur der DNA zu entdecken, als James Watson und James Crick 1953 ihre eigene Entdeckung der Struktur bekannt gaben). Später erhielt er den Friedensnobelpreis 1962 für seine Bemühungen um ein Verbot von Atomwaffentests.

Linus Pauling war einer der einflussreichsten Chemiker des 20. Jahrhunderts.
In seinen späteren Jahren war Pauling davon überzeugt, dass hohe Dosen von Vitamin C Krankheiten, einschließlich der Erkältung, verhindern würden. Die meisten klinischen Untersuchungen konnten keinen Zusammenhang nachweisen, aber Pauling nahm weiterhin täglich hohe Dosen ein. Er starb 1994, nachdem er sein ganzes Leben damit verbracht hatte, ein wissenschaftliches Vermächtnis zu schaffen, das nur wenige je erreichen werden.
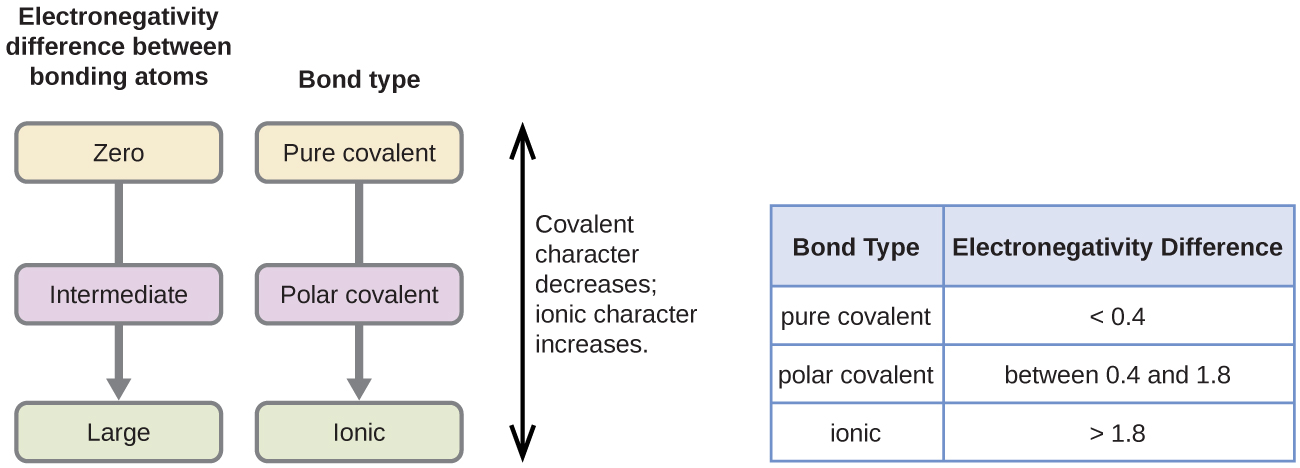
Die Polarität einer kovalenten Bindung kann durch die Bestimmung des Unterschieds der Elektronegativitäten der beiden Atome, die die Bindung eingehen, beurteilt werden. Je größer der Unterschied in der Elektronegativität ist, desto größer ist das Ungleichgewicht der Elektronenverteilung in der Bindung. Obwohl es keine festen Regeln gibt, gilt die allgemeine Regel, dass die Bindung als unpolar gilt, wenn der Unterschied in der Elektronegativität weniger als 0,4 beträgt; ist der Unterschied größer als 0,4, gilt die Bindung als polar. Ist der Elektronegativitätsunterschied groß genug (im Allgemeinen größer als etwa 1,8), wird die resultierende Verbindung als ionisch und nicht als kovalent betrachtet. Eine Elektronegativitätsdifferenz von Null bedeutet natürlich eine unpolare kovalente Bindung.
Beispiel \(\PageIndex{1}\)
Beschreiben Sie den Elektronegativitätsunterschied zwischen den einzelnen Atompaaren und die daraus resultierende Polarität (oder Bindungsart).
- C und H
- H und H
- Na und Cl
- O und H
Lösung
- Kohlenstoff hat eine Elektronegativität von 2,5, während der Wert für Wasserstoff 2,1 beträgt. Die Differenz beträgt 0,4, was recht gering ist. Die C-H-Bindung wird daher als unpolar angesehen.
- Beide Wasserstoffatome haben den gleichen Elektronegativitätswert – 2,1. Die Differenz ist Null, also ist die Bindung unpolar.
- Die Elektronegativität von Natrium ist 0,9, die von Chlor 3,0. Die Differenz beträgt 2,1, was ziemlich hoch ist, und so bilden Natrium und Chlor eine ionische Verbindung.
- Bei 2,1 für Wasserstoff und 3,5 für Sauerstoff beträgt die Elektronegativitätsdifferenz 1,4. Wir würden eine sehr polare Bindung erwarten. The sharing of electrons between O and H is unequal with the electrons more strongly drawn towards O.
Exercise \(\PageIndex{1}\)
Describe the electronegativity (EN) difference between each pair of atoms and the resulting polarity (or bond type).
- C and O
- K and Br
- N and N
- Cs and F
Answer a:
The EN difference is 1.0 , hence polar. The sharing of electrons between C and O is unequal with the electrons more strongly drawn towards O.
Answer b:
The EN difference is greater than 1.8, hence ionic.
Answer c:
Identical atoms have zero EN difference, hence nonpolar.
Answer d:
The EN difference is greater than 1.8, hence ionic.