 Die so genannte „Arterienverkalkung“ führt zu erhöhtem Blutdruck und ist letztlich ein bedeutender Risikofaktor für Thrombose und Herzerkrankungen. Bei der Arterienverkalkung handelt es sich um eine Verkalkung des Blutgefäßgewebes mit der gleichen Mineralform wie im Knochen, einem Kalziumphosphat, das mit dem Mineral Hydroxylapatit verwandt ist. Die Verkalkung kann auf fetthaltigen Ablagerungen (atherosklerotischen Plaques) im Inneren des Blutgefäßes (intimale oder atherosklerotische Verkalkung) oder in der mittleren Schicht der Blutgefäßwand (mediale Verkalkung) erfolgen, wobei letztere typischerweise mit dem Altern, Diabetes und Nierenerkrankungen in Verbindung gebracht wird.
Die so genannte „Arterienverkalkung“ führt zu erhöhtem Blutdruck und ist letztlich ein bedeutender Risikofaktor für Thrombose und Herzerkrankungen. Bei der Arterienverkalkung handelt es sich um eine Verkalkung des Blutgefäßgewebes mit der gleichen Mineralform wie im Knochen, einem Kalziumphosphat, das mit dem Mineral Hydroxylapatit verwandt ist. Die Verkalkung kann auf fetthaltigen Ablagerungen (atherosklerotischen Plaques) im Inneren des Blutgefäßes (intimale oder atherosklerotische Verkalkung) oder in der mittleren Schicht der Blutgefäßwand (mediale Verkalkung) erfolgen, wobei letztere typischerweise mit dem Altern, Diabetes und Nierenerkrankungen in Verbindung gebracht wird.
Es gibt deutliche Hinweise darauf, dass sich die Zellen in der Blutgefäßwand (vaskuläre glatte Muskelzellen) unter Stress in Richtung knochenähnlicher Zellen verändern und beginnen, Proteine zu exprimieren, die typischerweise mit Knochenverkalkung in Verbindung gebracht werden. Hier stellen sich viele Fragen: Was löst den Verkalkungsprozess in den Blutgefäßen aus; wie binden sich die Kalziumphosphatpartikel an das Blutgefäßgewebe oder an Fettablagerungen; warum sind einige verkalkte Plaques in den Blutgefäßen stabil, während bei anderen Brocken abbrechen und das Blutgefäß verstopfen?
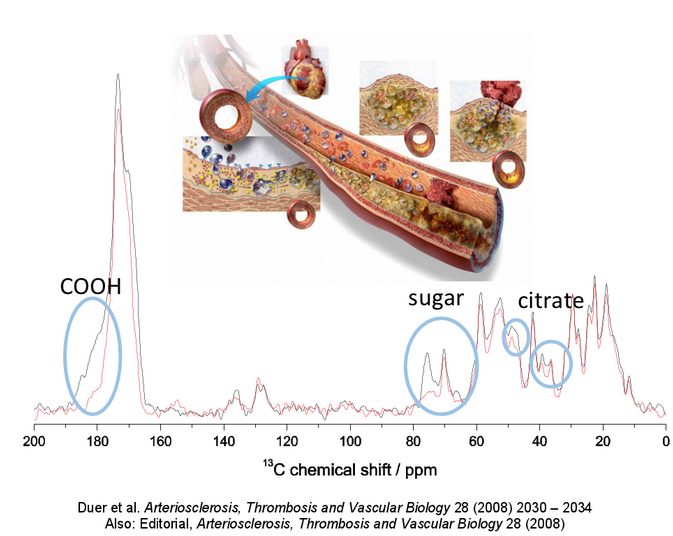
Unsere ersten Arbeiten auf diesem Gebiet (Arteriosklerose, Thrombose und Gefäßbiologie, 2008) haben gezeigt, dass dieselben Moleküle, die für die Bindung von Kalziumphosphatpartikeln im Knochen verantwortlich sind – funktionalisierte Zucker -, auch für diesen Prozess bei der Gefäßverkalkung zuständig sind. Wir arbeiten derzeit daran, diese Zucker zu identifizieren, in der Hoffnung, dass dann Hemmstoffe für ihre Funktion bei der Gefäßverkalkung entwickelt werden können.
In unserer jüngsten Arbeit haben wir gezeigt, dass die Tatsache, ob Citrat in die vaskulären Kalziumphosphatpartikel eingebaut ist oder nicht, einen großen Einfluss sowohl auf die Größe und Form der Partikel als auch darauf hat, wie toxisch sie für Zellen sind (Biomaterials, 2013). Tatsächlich wird Citrat häufig in verkalkte Gewebe, einschließlich Knochen, eingebaut (Calcified Tissue International, 2013), höchstwahrscheinlich, weil Kalzium in Form von Citratkomplexen zu den Verkalkungsstellen transportiert wird und die kleinen, nanoskaligen Poren, in denen die Verkalkung oft stattfindet, das transportierende Citrat nicht „entkommen“ lassen. Wir untersuchen nun die Möglichkeit, dass Citrat die mechanischen Eigenschaften von Kalziumphosphatpartikeln deutlich beeinflusst und erklären kann, warum manche verkalkte Gefäßplaques stabil sind und andere deutlich weniger.
Ein weiteres Merkmal der Gefäßverkalkung ist, dass ihr immer unmittelbar eine Zellnekrose vorausgeht, so dass wir untersuchen, welche Zellmoleküle bei diesem Prozess in der Gefäßwand abgelagert werden. So hoffen wir, feststellen zu können, welche funktionalisierten Zucker die Kalziumphosphatpartikel an das Gewebe binden.
Kollaborateure: Prof. Cathy Shanahan (Kings College London), Dr. Jeremy Skepper (PDN, University of Cambridge), Dr. Karin Muller (PDN, University of Cambridge)
Förderung: British Heart Foundation