Berechnung des Grades der Ungesättigtheit (DoU)
Der Grad der Ungesättigtheit (DoU) wird auch als Doppelbindungsäquivalent bezeichnet. Wenn die Summenformel angegeben ist, setzt man die Zahlen in diese Formel ein:
\
- \(C\) ist die Anzahl der Kohlenstoffe
- \(N\) ist die Anzahl der Stickstoffe
- \(X\) ist die Anzahl der Halogene (F, Cl, Br, I)
- \(H\) ist die Anzahl der Wasserstoffe
Wie bereits erwähnt, enthält ein gesättigtes Molekül nur Einfachbindungen und keine Ringe. Man kann dies auch so interpretieren, dass ein gesättigtes Molekül die größtmögliche Anzahl von Wasserstoffatomen hat, um ein azyklisches Alkan zu sein. Die Anzahl der Wasserstoffatome kann also durch 2C+2 dargestellt werden, was die allgemeine molekulare Darstellung eines Alkans ist. Für die Summenformel C3H4 beträgt die Anzahl der tatsächlich benötigten Wasserstoffatome 8, damit die Verbindung gesättigt ist. Die Verbindung benötigt 4 weitere Wasserstoffatome, um vollständig gesättigt zu sein (erwartete Anzahl der Wasserstoffatome – beobachtete Anzahl der Wasserstoffatome=8-4=4). Der Grad der Ungesättigtheit ist gleich 2 oder die Hälfte der Anzahl der Wasserstoffatome, die das Molekül benötigt, um als gesättigt eingestuft zu werden. Daher wird in der DoB-Formel durch 2 geteilt. In der Formel wird die Anzahl der X subtrahiert, da ein Halogen (X) einen Wasserstoff in einer Verbindung ersetzt. Zum Beispiel gibt es in Chlorethan, C2H5Cl, einen Wasserstoff weniger als in Ethan, C2H6.
Damit eine Verbindung gesättigt ist, gibt es einen Wasserstoff mehr in einem Molekül, wenn Stickstoff vorhanden ist. Daher addieren wir die Anzahl der Stickstoffatome (N). Dies zeigt sich bei C3H9N im Vergleich zu C3H8. Sauerstoff und Schwefel werden nicht in die Formel aufgenommen, da die Sättigung durch diese Elemente nicht beeinflusst wird. As seen in alcohols, the same number of hydrogens in ethanol, C2H5OH, matches the number of hydrogens in ethane, C2H6.
The following chart illustrates the possible combinations of the number of double bond(s), triple bond(s), and/or ring(s) for a given degree of unsaturation. Each row corresponds to a different combination.
- One degree of unsaturation is equivalent to 1 ring or 1 double bond (1 \( \pi \) bond).
- Two degrees of unsaturation is equivalent to 2 double bonds, 1 ring and 1 double bond, 2 rings, or 1 triple bond (2 \( \pi \) bonds).
|
DoU
|
Possible combinations of rings/ bonds
|
||
|---|---|---|---|
|
|
# of rings
|
# of double bonds
|
# of triple bonds
|
|
1
|
1
|
0
|
0
|
|
|
0
|
1
|
0
|
|
2
|
2
|
0
|
0
|
|
|
0
|
2
|
0
|
|
|
0
|
0
|
1
|
|
|
1
|
1
|
0
|
| 3 | 3 | 0 | 0 |
| 2 | 1 | 0 | |
| 1 | 2 | 0 | |
| 0 | 1 | 1 | |
| 0 | 3 | 0 | |
| 1 | 0 | 1 | |
Remember, der Grad der Ungesättigtheit gibt nur die Summe der Doppelbindungen, Dreifachbindungen und/oder Ringe an. Ein Ungesättigtheitsgrad von 3 kann zum Beispiel 3 Ringe, 2 Ringe+1 Doppelbindung, 1 Ring+2 Doppelbindungen, 1 Ring+1 Dreifachbindung, 1 Doppelbindung+1 Dreifachbindung oder 3 Doppelbindungen enthalten.
Beispiel: Benzol
Wie hoch ist der Ungesättigtheitsgrad von Benzol?
LÖSUNG
Die Summenformel für Benzol lautet C6H6. Also,
DoU= 4, wobei C=6, N=0,X=0, und H=6. 1 DoB kann 1 Ring oder 1 Doppelbindung entsprechen. Dies entspricht Benzol mit 1 Ring und 3 Doppelbindungen.
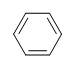
Benzol ist jedoch bei der Summenformel C6H6 nur eine von vielen möglichen Strukturen (Isomeren). Die folgenden Strukturen haben alle einen DoB von 4 und die gleiche Summenformel wie Benzol.