Einführung
Die ionische Bindung ist die vollständige Übertragung von Valenzelektronen zwischen Atomen. Sie ist eine Art chemischer Bindung, bei der zwei entgegengesetzt geladene Ionen entstehen. Bei einer ionischen Bindung gibt das Metall Elektronen ab und wird zu einem positiv geladenen Kation, während das Nichtmetall diese Elektronen aufnimmt und zu einem negativ geladenen Anion wird. Ionische Bindungen erfordern einen Elektronendonator, oft ein Metall, und einen Elektronenakzeptor, ein Nichtmetall.
Ionische Bindungen werden beobachtet, weil Metalle wenige Elektronen in ihren äußersten Orbitalen haben. Durch den Verlust dieser Elektronen können diese Metalle eine Edelgaskonfiguration erreichen und die Oktettregel erfüllen. In ähnlicher Weise nehmen Nichtmetalle, die fast 8 Elektronen in ihren Valenzschalen haben, leicht Elektronen auf, um die Edelgaskonfiguration zu erreichen. Bei Ionenbindungen kann mehr als 1 Elektron abgegeben oder aufgenommen werden, um die Oktettregel zu erfüllen. Die Ladungen des Anions und des Kations entsprechen der Anzahl der abgegebenen oder aufgenommenen Elektronen. Bei ionischen Bindungen muss die Nettoladung der Verbindung gleich Null sein.
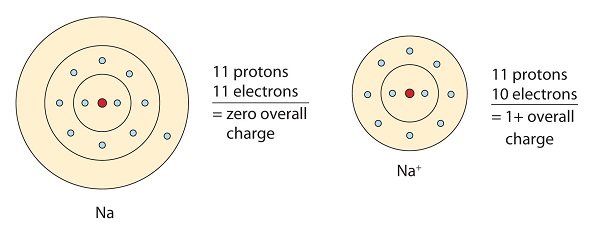
Dieses Natriummolekül gibt das einsame Elektron in seinem Valenzorbital ab, um die Oktettkonfiguration zu erreichen. Durch den Verlust des Elektrons entsteht ein positiv geladenes Kation.
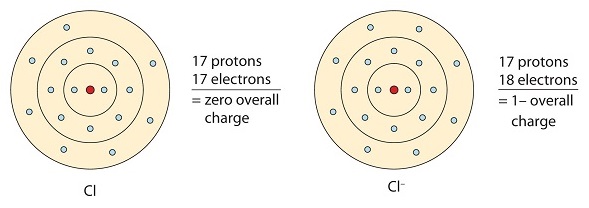
Dieses Chloratom erhält ein Elektron, um seine Oktettkonfiguration zu erreichen, wodurch ein negativ geladenes Anion entsteht.
Die vorhergesagte Gesamtenergie des Ionenbindungsprozesses, die die Ionisierungsenergie des Metalls und die Elektronenaffinität des Nichtmetalls einschließt, ist normalerweise positiv, was bedeutet, dass die Reaktion endotherm und ungünstig ist. Aufgrund der elektrostatischen Anziehungskraft zwischen den Teilchen ist diese Reaktion jedoch sehr vorteilhaft. Bei einem idealen interatomaren Abstand wird durch die Anziehung zwischen diesen Teilchen genügend Energie freigesetzt, um die Reaktion zu erleichtern. Die meisten ionischen Verbindungen neigen dazu, in polaren Lösungsmitteln zu dissoziieren, da sie oft polar sind. Dieses Phänomen ist auf die entgegengesetzten Ladungen der einzelnen Ionen zurückzuführen.
Beispiel \(\PageIndex{1}\): Chloridsalze
.jpg?revision=2)
In diesem Beispiel gibt das Natriumatom sein 1 Valenzelektron an das Chloratom ab. Dadurch entstehen ein Natriumkation und ein Chloranion. Beachten Sie, dass die Nettoladung der resultierenden Verbindung 0 ist.
.jpg?revision=2)
In diesem Beispiel gibt das Magnesiumatom beide Valenzelektronen an Chloratome ab. Jedes Chloratom kann nur 1 Elektron aufnehmen, bevor es seine Edelgaskonfiguration erreichen kann; daher sind 2 Chloratome erforderlich, um die 2 vom Magnesium abgegebenen Elektronen aufzunehmen. Notice that the net charge of the compound is 0.