- Lernziele
- B-Zellproduktion und -reifung
- Denken Sie darüber nach
- B-Zell-Rezeptoren
- Denken Sie darüber nach
- T-Zell-unabhängige Aktivierung von B-Zellen
- Denken Sie darüber nach
- T-Zell-abhängige Aktivierung von B-Zellen
- Denken Sie nach
- Primäre und sekundäre Reaktionen
- Denken Sie darüber nach
- Schlüsselkonzepte und Zusammenfassung
- Multiple Choice
- Fill in the Blank
- Think about It
Lernziele
- Beschreiben Sie die Produktion und Reifung von B-Zellen
- Vergleichen Sie die Struktur von B-Zell-Rezeptoren und T-Zell-Rezeptoren
- Vergleichen Sie die T-abhängige und T-unabhängige Aktivierung von B-Zellen
- Vergleiche die primäre und sekundäre Antikörperantwort
Humorale Immunität bezieht sich auf Mechanismen der adaptiven Immunabwehr, die durch Antikörper vermittelt werden, die von B-Lymphozyten sezerniert werden, oder B-Zellen. Dieser Abschnitt konzentriert sich auf B-Zellen und erörtert ihre Produktion und Reifung, Rezeptoren und Aktivierungsmechanismen.
B-Zellproduktion und -reifung
Wie T-Zellen werden B-Zellen aus multipotenten hämatopoetischen Stammzellen (HSCs) im Knochenmark gebildet und folgen einem Weg über lymphatische Stammzellen und Lymphoblasten (siehe Abbildung 1 in Zelluläre Abwehr). Im Gegensatz zu den T-Zellen verlassen die Lymphoblasten, die sich zu B-Zellen entwickeln sollen, jedoch nicht das Knochenmark und wandern zur Reifung in den Thymus. Vielmehr reifen die späteren B-Zellen weiterhin im Knochenmark.
Der erste Schritt der B-Zell-Reifung ist die Bewertung der Funktionalität ihrer Antigen-bindenden Rezeptoren. Dies geschieht durch positive Selektion auf B-Zellen mit normal funktionierenden Rezeptoren. Anschließend wird ein Mechanismus der negativen Selektion eingesetzt, um selbstreagierende B-Zellen zu eliminieren und das Risiko einer Autoimmunität zu minimieren. Die negative Selektion von selbstreagierenden B-Zellen kann die Eliminierung durch Apoptose, die Bearbeitung oder Veränderung der Rezeptoren, so dass sie nicht mehr selbstreagierend sind, oder die Induktion von Anergie in der B-Zelle beinhalten. Unreife B-Zellen, die die Selektion im Knochenmark durchlaufen haben, wandern dann für ihre letzten Reifungsschritte in die Milz. Dort werden sie zu naiven reifen B-Zellen, d. h.,
Denken Sie darüber nach
- Vergleichen Sie die Reifung von B-Zellen mit der Reifung von T-Zellen.
B-Zell-Rezeptoren
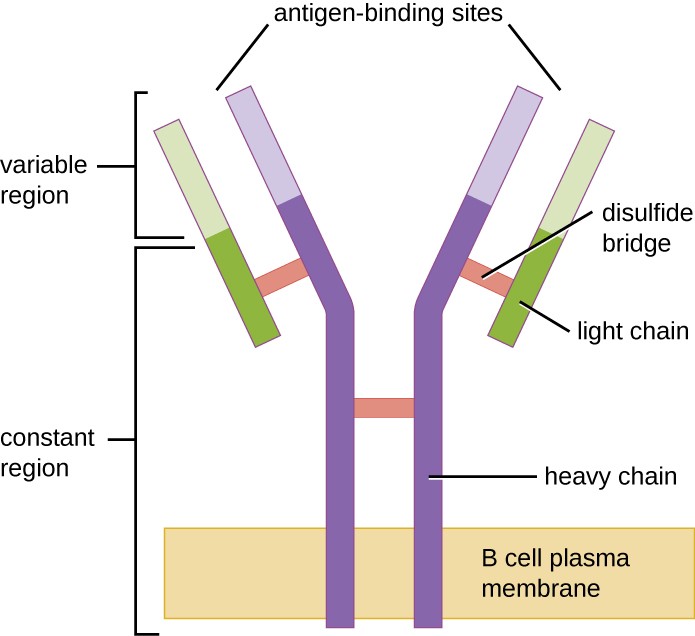
Abbildung 1. B-Zell-Rezeptoren sind in die Membranen von B-Zellen eingebettet. Die variablen Regionen aller Rezeptoren auf einer einzigen Zelle binden das gleiche spezifische Antigen.
Wie T-Zellen besitzen B-Zellen antigenspezifische Rezeptoren mit unterschiedlicher Spezifität. Obwohl sie für eine optimale Funktion auf T-Zellen angewiesen sind, können B-Zellen auch ohne Hilfe von T-Zellen aktiviert werden. B-Zell-Rezeptoren (BCRs) für naive reife B-Zellen sind membrangebundene monomere Formen von IgD und IgM. Sie bestehen aus zwei identischen schweren Ketten und zwei identischen leichten Ketten, die durch Disulfidbindungen zu einer Y-Grundform verbunden sind (Abbildung 1). Der Rumpf des Y-förmigen Moleküls, die konstante Region der beiden schweren Ketten, überspannt die B-Zellmembran. Die beiden Antigenbindungsstellen, die an der Außenseite der B-Zelle exponiert sind, sind an der Bindung spezifischer Pathogenepitope beteiligt, um den Aktivierungsprozess einzuleiten. Man schätzt, dass jede naive, reife B-Zelle mehr als 100.000 BCRs auf ihrer Membran hat, und jeder dieser BCRs hat eine identische Epitopbindungsspezifität.
Um auf eine breite Palette von mikrobiellen Epitopen reagieren zu können, verwenden B-Zellen wie T-Zellen eine genetische Umstrukturierung von Hunderten von Gensegmenten, um die notwendige Vielfalt von Rezeptorspezifitäten bereitzustellen. Die variable Region der schweren Kette des BCR besteht aus V-, D- und J-Segmenten, ähnlich wie die β-Kette des TCR. Die variable Region der leichten BCR-Kette besteht aus V- und J-Segmenten, ähnlich wie die α-Kette des TCR. Durch die genetische Neuanordnung aller möglichen Kombinationen von V-J-D (schwere Kette) und V-J (leichte Kette) entstehen Millionen einzigartiger Antigenbindungsstellen für den BCR und für die nach der Aktivierung sezernierten Antikörper.
Ein wichtiger Unterschied zwischen BCRs und TCRs ist die Art und Weise, wie sie mit antigenen Epitopen interagieren können. Während TCRs nur mit antigenen Epitopen interagieren können, die innerhalb des antigenbindenden Spalts von MHC I oder MHC II präsentiert werden, benötigen BCRs keine Antigenpräsentation mit MHC; sie können mit Epitopen auf freien Antigenen oder mit Epitopen auf der Oberfläche intakter Pathogene interagieren. Ein weiterer wichtiger Unterschied besteht darin, dass TCRs nur Proteinepitope erkennen, während BCRs Epitope erkennen können, die mit verschiedenen Molekülklassen assoziiert sind (z. B. Proteine, Polysaccharide, Lipopolysaccharide).
Die Aktivierung von B-Zellen erfolgt je nach Molekülklasse des Antigens durch unterschiedliche Mechanismen. Die Aktivierung einer B-Zelle durch ein Proteinantigen erfordert, dass die B-Zelle als APC fungiert und die Proteinepitope mit MHC II den T-Helferzellen präsentiert. Aufgrund ihrer Abhängigkeit von T-Zellen für die Aktivierung von B-Zellen werden Proteinantigene als T-abhängige Antigene eingestuft. Im Gegensatz dazu werden Polysaccharide, Lipopolysaccharide und andere Nicht-Protein-Antigene als T-unabhängige Antigene betrachtet, da sie B-Zellen aktivieren können, ohne dass das Antigen verarbeitet und T-Zellen präsentiert wird.
Denken Sie darüber nach
- Welche Arten von Molekülen dienen als BCR?
- Was sind die Unterschiede zwischen TCRs und BCRs in Bezug auf die Antigenerkennung?
- Welche Molekülklassen sind T-abhängige Antigene und welche sind T-unabhängige Antigene?
T-Zell-unabhängige Aktivierung von B-Zellen
Die Aktivierung von B-Zellen ohne die Mitarbeit von T-Helferzellen wird als T-Zell-unabhängige Aktivierung bezeichnet und tritt auf, wenn BCRs mit T-unabhängigen Antigenen interagieren. T-unabhängige Antigene (z. B. Polysaccharidkapseln, Lipopolysaccharid) haben sich wiederholende Epitopeinheiten in ihrer Struktur, und diese Wiederholung ermöglicht die Vernetzung mehrerer BCRs, was das erste Signal für die Aktivierung darstellt (Abbildung 2). Da T-Zellen nicht beteiligt sind, muss das zweite Signal aus anderen Quellen stammen, wie z. B. Wechselwirkungen von Toll-like-Rezeptoren mit PAMPs oder Wechselwirkungen mit Faktoren des Komplementsystems.
Wenn eine B-Zelle aktiviert ist, unterliegt sie einer klonalen Proliferation und die Tochterzellen differenzieren sich zu Plasmazellen. Plasmazellen sind Antikörperfabriken, die große Mengen von Antikörpern absondern. Nach der Differenzierung verschwinden die BCRs an der Oberfläche und die Plasmazelle sezerniert pentamere IgM-Moleküle, die dieselbe Antigenspezifität wie die BCRs haben (Abbildung 2).
Die T-Zell-unabhängige Reaktion ist kurzlebig und führt nicht zur Bildung von Gedächtnis-B-Zellen. Daher führt sie nicht zu einer sekundären Reaktion auf nachfolgende Expositionen gegenüber T-unabhängigen Antigenen.

Abbildung 2. T-unabhängige Antigene haben sich wiederholende Epitope, die die Erkennung und Aktivierung von B-Zellen ohne Beteiligung von T-Zellen auslösen können. Ein zweites Signal, wie die Interaktion von TLRs mit PAMPs (nicht gezeigt), ist ebenfalls für die Aktivierung der B-Zelle erforderlich. Sobald sie aktiviert ist, vermehrt sich die B-Zelle und differenziert sich in antikörperbildende Plasmazellen.
Denken Sie darüber nach
- Welche zwei Signale sind für die T-Zell-unabhängige Aktivierung von B-Zellen erforderlich?
- Was ist die Funktion einer Plasmazelle?
T-Zell-abhängige Aktivierung von B-Zellen

Abbildung 3. Klicken Sie für eine größere Darstellung. Bei der T-Zell-abhängigen Aktivierung von B-Zellen erkennt und internalisiert die B-Zelle ein Antigen und präsentiert es einer T-Helferzelle, die für das gleiche Antigen spezifisch ist. Die T-Helferzelle interagiert mit dem von der B-Zelle präsentierten Antigen, wodurch die T-Zelle aktiviert und die Freisetzung von Zytokinen angeregt wird, die dann die B-Zelle aktivieren. Die Aktivierung der B-Zelle löst die Proliferation und Differenzierung in B-Zellen und Plasmazellen aus.
Die T-Zell-abhängige Aktivierung von B-Zellen ist komplexer als die T-Zell-unabhängige Aktivierung, aber die daraus resultierende Immunantwort ist stärker und entwickelt ein Gedächtnis. Die T-Zell-abhängige Aktivierung kann entweder als Reaktion auf freie Proteinantigene oder auf mit einem intakten Erreger assoziierte Proteinantigene erfolgen. Die Interaktion zwischen den BCRs auf einer naiven reifen B-Zelle und einem freien Proteinantigen stimuliert die Internalisierung des Antigens, während die Interaktion mit Antigenen, die mit einem intakten Pathogen assoziiert sind, die Extraktion des Antigens aus dem Pathogen vor der Internalisierung einleitet. Nach der Internalisierung in der B-Zelle wird das Proteinantigen verarbeitet und mit MHC II präsentiert. Das präsentierte Antigen wird dann von T-Helferzellen erkannt, die für dasselbe Antigen spezifisch sind. Der TCR der T-Helferzelle erkennt das fremde Antigen, und das CD4-Molekül der T-Zelle interagiert mit MHC II auf der B-Zelle. Die Koordination zwischen B-Zellen und T-Helferzellen, die für dasselbe Antigen spezifisch sind, wird als verknüpfte Erkennung bezeichnet.
Nach der Aktivierung durch die verknüpfte Erkennung produzieren und sezernieren TH2-Zellen Zytokine, die die B-Zelle aktivieren und eine Proliferation in klonale Tochterzellen verursachen. Nach mehreren Proliferationsrunden stimulieren zusätzliche Zytokine, die von den TH2-Zellen bereitgestellt werden, die Differenzierung der aktivierten B-Zellklone in Gedächtnis-B-Zellen, die schnell auf nachfolgende Expositionen gegenüber demselben Proteinepitop reagieren, und in Plasmazellen, die ihre Membran-BCRs verlieren und zunächst pentameres IgM sezernieren (Abbildung 3).
Nach der anfänglichen Sekretion von IgM stimulieren die von TH2-Zellen ausgeschütteten Zytokine die Plasmazellen dazu, von der IgM-Produktion auf die Produktion von IgG, IgA oder IgE umzuschalten. Dieser Prozess, der als Klassenwechsel oder Isotypwechsel bezeichnet wird, ermöglicht es Plasmazellen, die aus ein und derselben aktivierten B-Zelle geklont wurden, eine Vielzahl von Antikörperklassen mit derselben Epitopspezifität zu produzieren. Der Klassenwechsel wird durch eine genetische Umstrukturierung von Gensegmenten erreicht, die für die konstante Region kodieren, die die Klasse eines Antikörpers bestimmt. Die variable Region wird nicht verändert, so dass die neue Antikörperklasse die ursprüngliche Epitopspezifität beibehält.
Denken Sie nach
- Welche Schritte sind für die T-Zell-abhängige Aktivierung von B-Zellen erforderlich?
- Was ist ein Antikörperklassenwechsel und warum ist er wichtig?
Primäre und sekundäre Reaktionen
Die T-Zell-abhängige Aktivierung von B-Zellen spielt eine wichtige Rolle sowohl bei den primären als auch bei den sekundären Reaktionen im Rahmen der adaptiven Immunität. Bei der ersten Exposition gegenüber einem Proteinantigen kommt es zu einer T-Zell-abhängigen primären Antikörperreaktion. Das Anfangsstadium der primären Reaktion ist eine Verzögerungszeit oder latente Periode von etwa 10 Tagen, in der keine Antikörper im Serum nachgewiesen werden können. Diese Latenzzeit ist die Zeit, die für alle Schritte der Primärreaktion benötigt wird, einschließlich der Bindung von Antigenen an BCRs durch naive reife B-Zellen, der Antigenverarbeitung und -präsentation, der Aktivierung von T-Helferzellen, der Aktivierung von B-Zellen und der klonalen Proliferation. Das Ende der Verzögerungsphase ist durch einen Anstieg der IgM-Konzentrationen im Serum gekennzeichnet, da TH2-Zellen die Differenzierung der B-Zellen zu Plasmazellen stimulieren. Die IgM-Spiegel erreichen etwa 14 Tage nach der primären Antigenexposition ihren Höchststand; etwa zur gleichen Zeit stimuliert TH2 den Wechsel der Antikörperklassen, und die IgM-Spiegel im Serum beginnen zu sinken. In der Zwischenzeit steigen die IgG-Konzentrationen an, bis sie etwa drei Wochen nach der Primärreaktion ihren Höhepunkt erreichen (Abbildung 4).
Während der Primärreaktion differenzieren sich einige der geklonten B-Zellen zu Gedächtnis-B-Zellen, die darauf programmiert sind, auf nachfolgende Expositionen zu reagieren. Diese sekundäre Reaktion erfolgt schneller und heftiger als die primäre Reaktion. Die Verzögerungszeit ist auf wenige Tage verkürzt, und die IgG-Produktion ist deutlich höher als bei der Primärreaktion (Abbildung 4). Darüber hinaus sind die bei der Sekundärreaktion gebildeten Antikörper wirksamer und binden mit höherer Affinität an die Ziel-Epitope. Plasmazellen, die während der Sekundärreaktion produziert werden, leben länger als die während der Primärreaktion produzierten, so dass die Spiegel spezifischer Antikörper über einen längeren Zeitraum erhöht bleiben.

Abbildung 4. Im Vergleich zur Primärreaktion tritt die sekundäre Antikörperreaktion schneller ein und erzeugt höhere und länger anhaltende Antikörperspiegel. An der sekundären Reaktion ist meist IgG beteiligt.
Denken Sie darüber nach
- Welche Ereignisse treten während der Verzögerungszeit der primären Antikörperreaktion auf?
- Warum bleiben die Antikörperspiegel während der sekundären Antikörperreaktion länger erhöht?
Schlüsselkonzepte und Zusammenfassung
- B-Lymphozyten oder B-Zellen produzieren Antikörper, die an der humoralen Immunität beteiligt sind. B-Zellen werden im Knochenmark produziert, wo die ersten Reifungsstadien stattfinden, und wandern in die Milz, um die letzten Schritte der Reifung zu naiven reifen B-Zellen zu vollziehen.
- B-Zell-Rezeptoren (BCRs) sind membrangebundene monomere Formen von IgD und IgM, die mit ihren Fab-Antigenbindungsregionen spezifische Antigenepitope binden. Die Vielfalt der Antigenbindungsspezifität entsteht durch eine genetische Neuanordnung der V-, D- und J-Segmente, ähnlich dem Mechanismus, der für die TCR-Vielfalt verwendet wird.
- Proteinantigene werden als T-abhängige Antigene bezeichnet, weil sie B-Zellen nur unter Mitwirkung von T-Helferzellen aktivieren können. Andere Molekülklassen erfordern keine T-Zell-Kooperation und werden als T-unabhängige Antigene bezeichnet.
- Die T-Zell-unabhängige Aktivierung von B-Zellen beinhaltet die Quervernetzung von BCRs durch repetitive Nicht-Protein-Antigen-Epitope. Sie ist durch die Produktion von IgM durch Plasmazellen gekennzeichnet und führt nicht zur Bildung von B-Gedächtniszellen.
- Die T-Zell-abhängige Aktivierung von B-Zellen umfasst die Verarbeitung und Präsentation von Proteinantigenen für Helfer-T-Zellen, die Aktivierung der B-Zellen durch Zytokine, die von aktivierten TH2-Zellen abgesondert werden, und Plasmazellen, die infolge des Klassenwechsels verschiedene Klassen von Antikörpern produzieren. Es werden auch Gedächtnis-B-Zellen gebildet.
- Sekundäre Expositionen gegenüber T-abhängigen Antigenen führen zu einer sekundären Antikörperreaktion, die von Gedächtnis-B-Zellen initiiert wird. Die sekundäre Reaktion entwickelt sich schneller und produziert höhere und dauerhaftere Mengen an Antikörpern mit höherer Affinität für das spezifische Antigen.
Multiple Choice
Welches der folgenden ist ein T-abhängiges Antigen?
- lipopolysaccharide
- glycolipid
- protein
- carbohydrate
Which of the following would be a BCR?
- CD4
- MHC II
- MHC I
- IgD
Which of the following does not occur during the lag period of the primary antibody response?
- activation of helper T cells
- class switching to IgG
- presentation of antigen with MHC II
- binding of antigen to BCRs
Fill in the Blank
________ antigens can stimulate B cells to become activated but require cytokine assistance delivered by helper T cells.
T-independent antigens can stimulate B cells to become activated and secrete antibodies without assistance from helper T cells. These antigens possess ________ antigenic epitopes that cross-link BCRs.
Think about It
A patient lacks the ability to make functioning T cells because of a genetic disorder. Would this patient’s B cells be able to produce antibodies in response to an infection? Explain your answer.