Formale ladingen
Organische moleculen kunnen ook positieve of negatieve ladingen met zich meebrengen. Tijdens chemische reacties is het gebruikelijk dat reactanten, tussenproducten en/of producten een lading hebben. Het herkennen van en onderscheid maken tussen neutrale en geladen bindingspatronen zal nuttig zijn bij het leren van reactiemechanismen. Neem de Lewisstructuur van methanol, CH3OH (methanol is de zogenaamde “houtalcohol” die gewetenloze smokkelaars soms verkochten tijdens de drooglegging in de jaren 1920, waardoor de mensen die het dronken vaak blind werden). Methanol zelf is een neutraal molecuul, maar kan een proton verliezen om een moleculair anion (CH3O-) te worden, of een proton winnen om een moleculair kation (CH3OH2+) te worden.

Het moleculaire anion en kation hebben een algemene lading van respectievelijk -1 en +1. Maar we kunnen specifieker zijn dan dat – we kunnen voor elk molecuulion ook zeggen dat de formele lading specifiek op het zuurstofatoom zit, en niet op het koolstofatoom of een van de waterstofatomen.
Het bepalen van de formele lading op verschillende atomen van een molecuul is een eenvoudig proces – het is gewoon een kwestie van valentie-elektronen optellen.
Een ongebonden zuurstofatoom heeft 6 valentie-elektronen. Wanneer het echter gebonden is als onderdeel van een methanolmolecuul, is een zuurstofatoom omgeven door 8 valentie-elektronen: 4 niet-bindende elektronen (twee ‘lone pairs’) en 2 elektronen in elk van zijn twee covalente bindingen (één met koolstof, één met waterstof). In de formele ladingsconventie zeggen we dat de zuurstof alle vier de niet-bindende elektronen ‘bezit’. Het ‘bezit’ echter slechts één elektron van elk van de twee covalente bindingen, omdat bij covalente bindingen de elektronen tussen atomen worden gedeeld. Het zuurstofatoom in methanol bezit dus 2 + 2 + (½ x 4) = 6 valentie-elektronen.
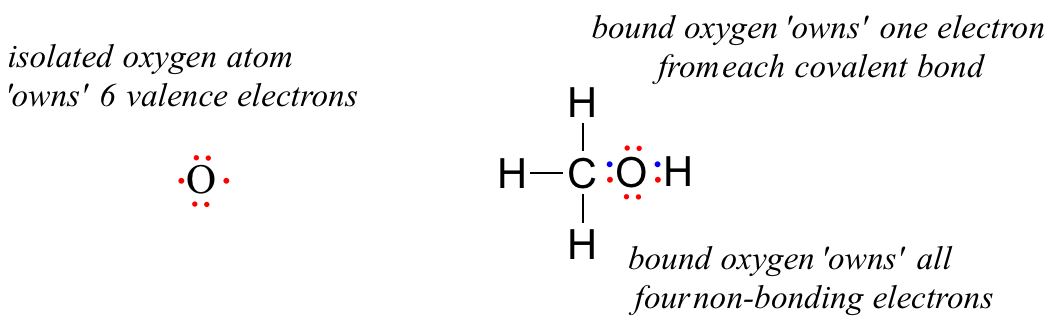
The formal charge on an atom is calculated as the number of valence electrons owned by the isolated atom minus the number of valence electrons owned by the bound atom in the molecule:
Determining formal charge on an atom
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of valence electrons owned by the bound atom)
or . . .
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of non-bonding electrons on the bound atom)
– ( ½ the number of bonding electrons on the bound atom)
Using this formula for the oxygen atom of methanol, we have:
formal charge on oxygen =
(6 valence electrons on isolated atom)
– (4 non-bonding electrons)
– (½ x 4 bonding electrons)
= 6 – 4 – 2 = 0. Thus, oxygen in methanol has a formal charge of zero (in other words, it has no formal charge).
How about the carbon atom in methanol? An isolated carbon owns 4 valence electrons. The bound carbon in methanol owns (½ x 8) = 4 valence electrons:
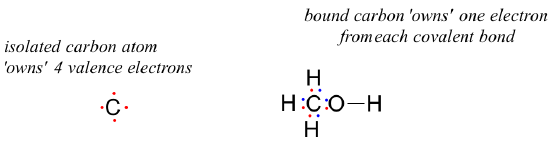
formal charge on carbon =
(4 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 8 bonding electrons)
= 4 – 0 – 4 = 0. So the formal charge on carbon is zero.
For each of the hydrogens in methanol, we also get a formal charge of zero:
formal charge on hydrogen =
(1 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 2 bonding electrons)
= 1 – 0 – 1 = 0
Now, let’s look at the cationic form of methanol, CH3OH2+. The bonding picture has not changed for carbon or for any of the hydrogen atoms, so we will focus on the oxygen atom.
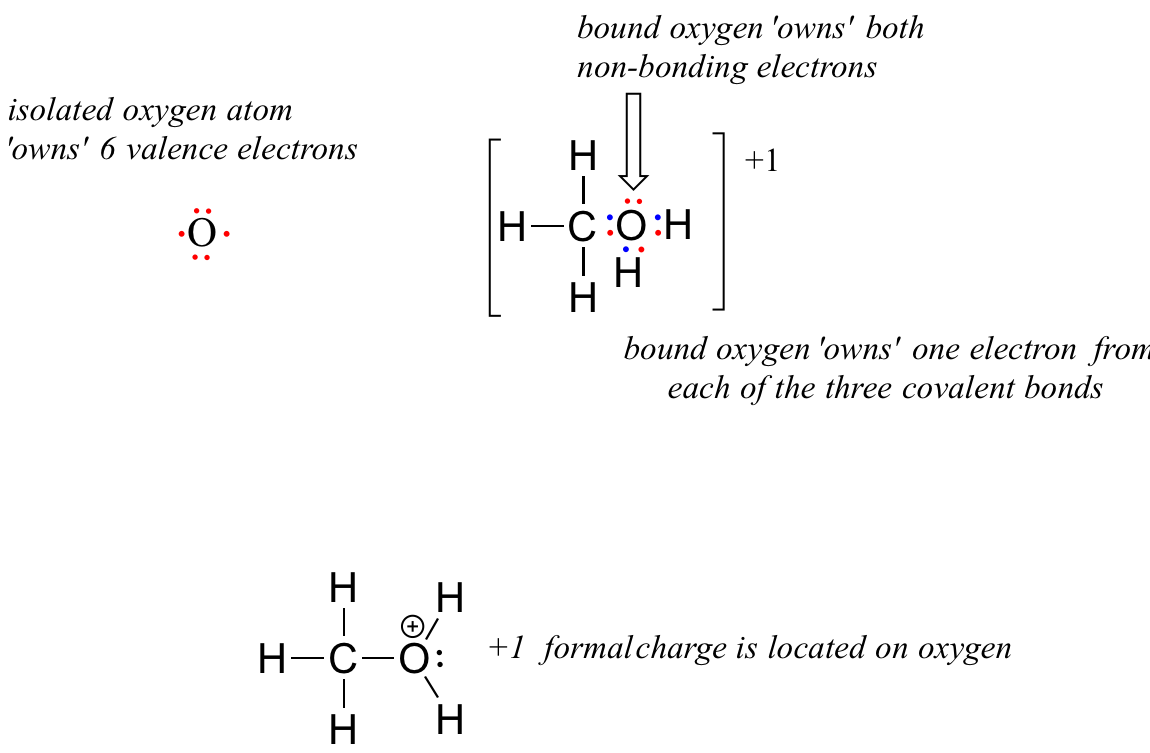
The oxygen owns 2 non-bonding electrons and 3 bonding elections, so the formal charge calculations becomes:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (2 non-bonding electrons)
– (½ x 6 bonding electrons)
= 6 – 2 – 3 = 1. A formal charge of +1 is located on the oxygen atom.
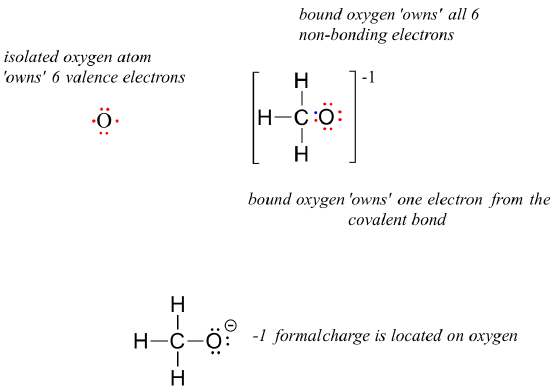
For methoxide, the anionic form of methanol, the calculation for the oxygen atom is:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (6 non-bonding electrons)
– (½ x 2 bonding electrons)
= 6 – 6 – 1 = -1. A formal charge of -1 is located on the oxygen atom.
A very important rule to keep in mind is that the sum of the formal charges on all atoms of a molecule must equal the net charge on the whole molecule.
Bij het tekenen van de structuren van organische moleculen is het van groot belang dat alle niet-nul formele ladingen worden weergegeven, waarbij duidelijk moet zijn waar de ladingen zich bevinden. Een structuur waarin de niet-nul formele ladingen ontbreken, is niet correct getekend, en zal op het examen waarschijnlijk als zodanig worden beoordeeld!
Als je nu terugdenkt aan wat je in de algemene scheikunde hebt geleerd, vraag je je waarschijnlijk af: “Hoe zit het met dipolen? Is een zuurstofatoom in een O-H binding niet ‘eigenaar’ van meer elektronendichtheid dan de waterstof, vanwege zijn grotere elektronegativiteit?” Dit is volkomen juist, en we zullen het concept van bindingsdipolen later bespreken. Maar voor het berekenen van formele ladingen doen bindingsdipolen er niet toe – we beschouwen de twee elektronen in een binding altijd als gelijk gedeeld, ook al is dat geen nauwkeurige weergave van de chemische werkelijkheid. Formele ladingen zijn slechts dat – een formaliteit, een methode van elektronenboekhouding die is verbonden met het Lewis-systeem voor het tekenen van de structuren van organische verbindingen en ionen. Later zullen we zien hoe het concept van de formele lading ons kan helpen te visualiseren hoe organische moleculen reageren.
Ten slotte, laat u niet verleiden tot de gedachte dat alleen omdat de netto lading van een structuur nul is, er geen atomen zijn met formele ladingen: één atoom zou een positieve formele lading kunnen hebben en een ander een negatieve formele lading, en de netto lading zou nog steeds nul zijn. Zwitterionen, zoals aminozuren, hebben zowel positieve als negatieve formele ladingen op verschillende atomen:

Ook al is de netto lading op glycine nul, het is toch nodig om de plaats van de positieve en negatieve formele ladingen aan te geven.
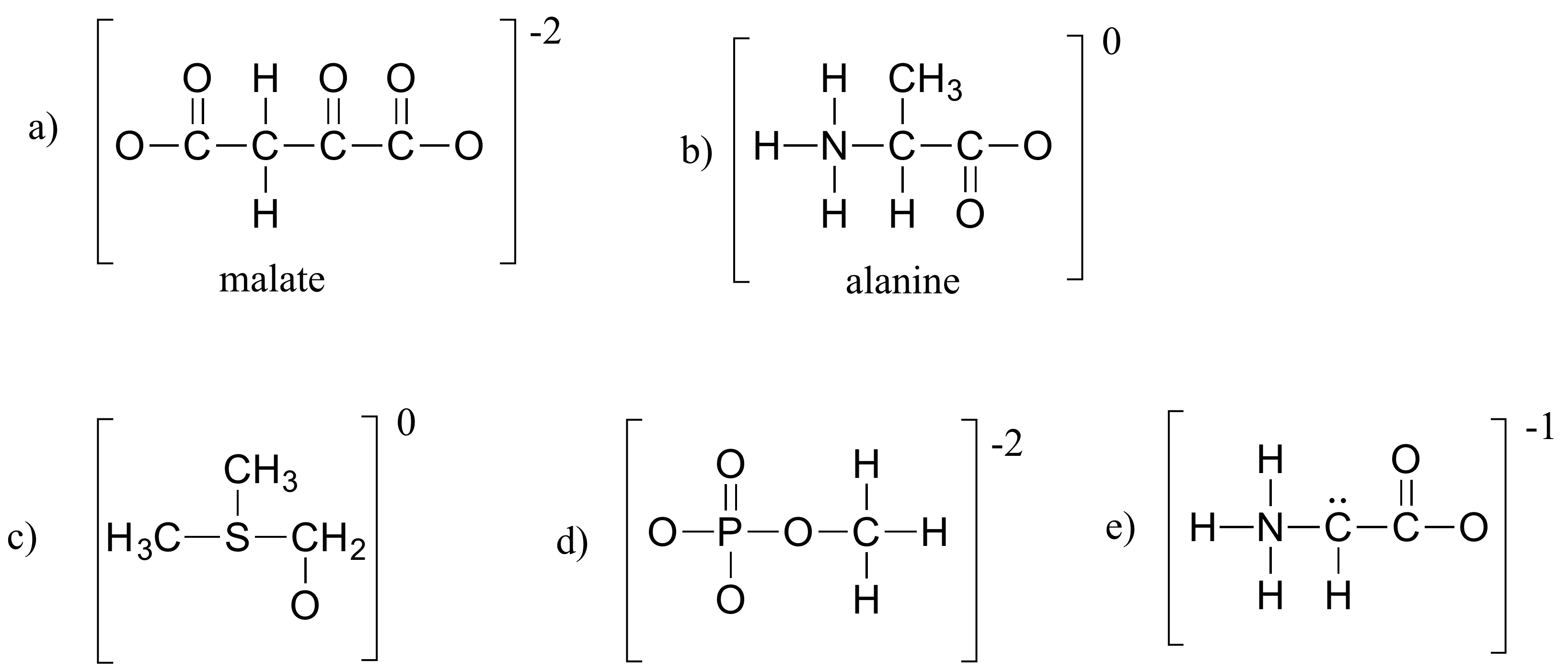
Oefening 1.4
Vul alle ontbrekende eenpaarelektronen en formele ladingen in de structuren hieronder in. Ga ervan uit dat alle atomen een volledige valentieschil van elektronen hebben. De netto ladingen staan buiten de haakjes.
Oplossingen bij oefeningen