MO-theorie en geconjugeerde Pi-bindingen
Het voordeel van het gebruik van MO-theorie om bindingen in organische moleculen te begrijpen wordt duidelijker als we denken aan Pi-bindingen. Laten we eerst de pi binding in etheen bekijken vanuit een MO theorie standpunt (in dit voorbeeld laten we de s bindingen in het molecuul buiten beschouwing, en denken we alleen aan de π binding). We beginnen met twee atomaire banen: een ongebrugde 2p baan van elke koolstof. Elk bevat een enkel elektron. In de MO-theorie combineren de twee atomaire banen zich wiskundig tot twee pi moleculaire banen, een laag-energetische pi bindingsbaan en een hoog-energetische pi* anti-bindingsbaan.
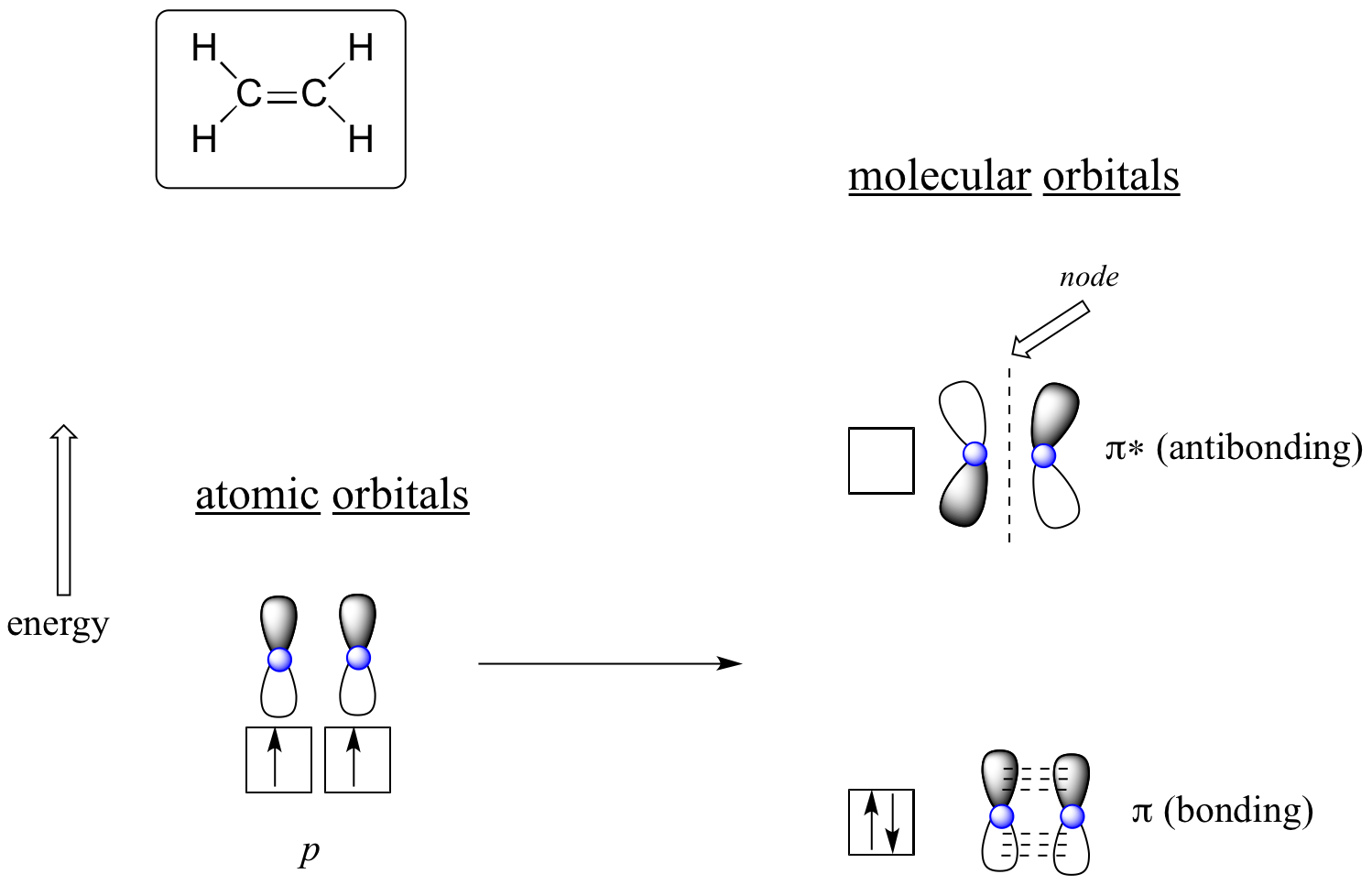
Moleculaire banen voor etheen (ethyleen)
In de bindende pi orbitaal hebben de twee gearceerde lobben van de p orbitalen een constructieve wisselwerking met elkaar, net als de twee niet-gearceerde lobben (vergeet niet dat de willekeurige keuze van arcering staat voor wiskundige (+) en (-) tekens voor de wiskundige golffunctie die de orbitaal beschrijft). Er is een verhoogde elektronendichtheid tussen de twee koolstofkernen in de moleculaire orbitaal – het is een bindingsinteractie.
In de hogere-energie anti-bonding pi* orbitaal, interageert de gearceerde lob van de ene p orbitaal destructief met de niet-gearceerde lob van de tweede p orbitaal, wat leidt tot een knoop tussen de twee kernen en een algehele afstoting tussen de koolstofkernen.
Wederom gebruikmakend van het ‘opbouw’-principe, plaatsen we de twee elektronen in de laagenergetische, bindende pi moleculaire orbitaal. De antibonding pi* orbitaal blijft leeg.
Volgende beschouwen we het 1,3-butadieen molecuul. Op grond van de valentiebanktheorie alleen zouden we verwachten dat de C2-C3 binding in dit molecuul, omdat het een sigma binding is, vrij zou kunnen roteren.

Experimenteel is echter waargenomen dat er een significante barrière is voor rotatie om de C2-C3 binding, en dat het hele molecuul planair is. Bovendien is de C2-C3 binding 148 pm lang, korter dan een typische enkelvoudige koolstof-koolstof binding (ongeveer 154 pm), maar langer dan een typische dubbele binding (ongeveer 134 pm).
Moleculaire orbitaaltheorie verklaart deze waarnemingen met het concept van gedelokaliseerde pi bindingen. In dit beeld combineren de vier 2p atomaire banen zich mathematisch tot vier pi moleculaire banen van toenemende energie. Twee daarvan – de bindende pi orbitalen – zijn lager in energie dan de p atomaire orbitalen waaruit ze zijn gevormd, terwijl twee – de antibindende pi* orbitalen – hoger in energie zijn.

De moleculaire orbitaal met de laagste energie, pi1, heeft alleen constructieve interactie en nul knooppunten. De pi2 orbitaal, die hoger in energie is, maar nog steeds lager dan de geïsoleerde p orbitalen, heeft één knoop maar twee constructieve interacties – dus is het over het geheel genomen nog steeds een bindende orbitaal. Kijken we naar de twee antibonding banen, dan heeft pi3* twee knopen en één constructieve interactie, terwijl pi4* drie knopen en nul constructieve interacties heeft.
Op grond van het aufbau-principe worden de vier elektronen uit de geïsoleerde 2pz atomaire banen in de bindende pi1 en pi2 MO’s geplaatst. Omdat pi1 constructieve interactie tussen C2 en C3 omvat, is er in het 1,3-butadieen molecuul een zekere mate van pi-bindingsinteractie tussen deze twee koolstaven, die de kortere lengte en de barrière tot rotatie verklaart. Het valentiebindingsbeeld van 1,3-butadieen toont de twee pi bindingen als geïsoleerd van elkaar, waarbij elk paar pi elektronen in zijn eigen pi binding ‘vastzit’. De moleculaire orbitaaltheorie voorspelt echter (nauwkeurig) dat de vier pi elektronen tot op zekere hoogte gedelokaliseerd zijn, of ‘uitgespreid’, over het hele pi systeem.
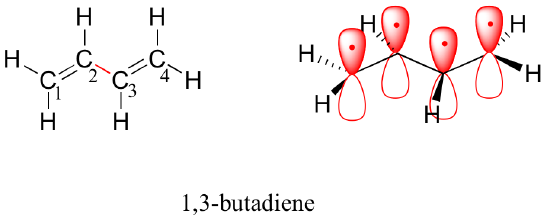
ruimtevullende weergave
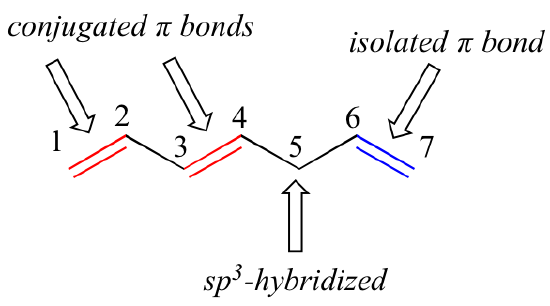
1,3-butadieen is het eenvoudigste voorbeeld van een systeem van geconjugeerde pi bindingen. Om als geconjugeerd te worden beschouwd, moeten twee of meer pi bindingen worden gescheiden door slechts een enkele binding – met andere woorden, er mag geen tussenliggende sp3-gehybridiseerde koolstof zijn, omdat dit het overlappende systeem van parallelle p-banen zou verbreken. In de verbinding hieronder zijn bijvoorbeeld de dubbele bindingen C1-C2 en C3-C4 geconjugeerd, terwijl de dubbele binding C6-C7 van de andere twee pi-bindingen is geïsoleerd door de sp3-gehybridiseerde C5.
Een zeer belangrijk concept om in gedachten te houden is dat er een inherente thermodynamische stabiliteit is verbonden aan conjugatie. Deze stabiliteit kan experimenteel worden gemeten door de warmte van hydrogenering van twee verschillende dienen te vergelijken. (Hydrogenering is een reactietype waarover we in hoofdstuk 15 veel meer zullen leren: in wezen is het het proces waarbij een waterstofmolecuul – twee protonen en twee elektronen – aan een p-binding wordt toegevoegd). Wanneer de twee geconjugeerde dubbele bindingen van 1,3-pentadieen worden “gehydrogeneerd” om pentaan te produceren, komt er ongeveer 225 kJ vrij per mol gevormd pentaan. Vergelijk dat eens met de ongeveer 250 kJ/mol die vrijkomt als de twee geïsoleerde dubbele bindingen in 1,4-pentadieen worden gehydrogeneerd, waarbij ook pentaan wordt gevormd.
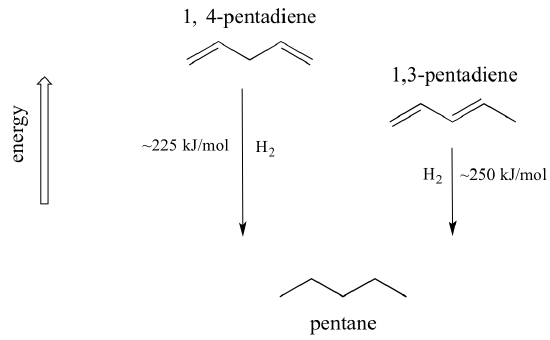
Het geconjugeerde diene is lager in energie: met andere woorden, het is stabieler. In het algemeen zijn geconjugeerde pi bindingen stabieler dan geïsoleerde pi bindingen.
Geconjugeerde pi systemen kunnen naast koolstof ook zuurstof- en stikstofatomen bevatten. In het metabolisme van vetmoleculen hebben sommige van de belangrijkste reacties betrekking op alkenen die aan carbonylgroepen zijn geconjugeerd.

In hoofdstuk 4 zullen we zien dat de MO-theorie heel nuttig is om te verklaren waarom organische moleculen die uitgebreide systemen van geconjugeerde pi bindingen bevatten vaak een kenmerkende kleur hebben. Bètacaroteen, de verbinding die verantwoordelijk is voor de oranje kleur van wortels, heeft een uitgebreid systeem van 11 geconjugeerde pi bindingen.
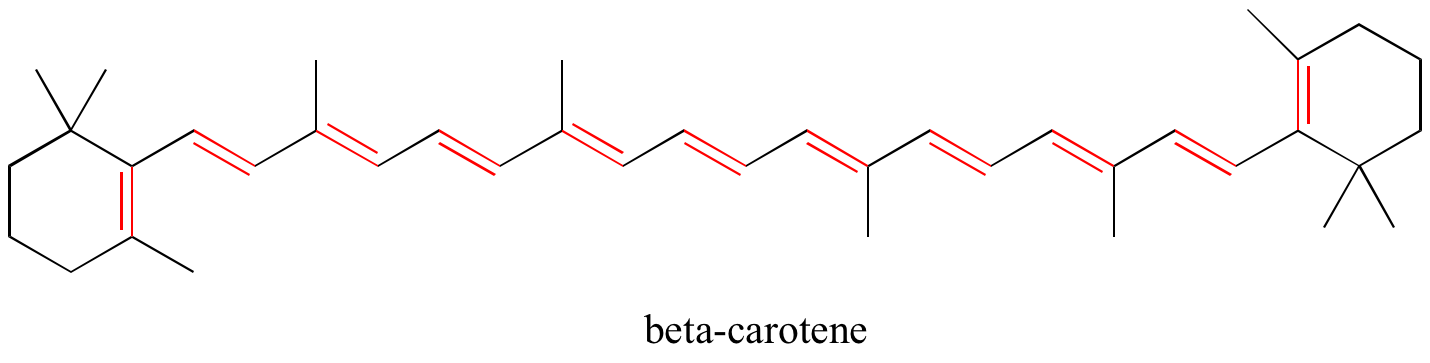
Oefening: Identificeer alle geconjugeerde en geïsoleerde dubbele bindingen in de onderstaande structuren. Geef voor elk geconjugeerd pi-systeem het aantal overlappende p-banen aan, en hoeveel pi-elektronen er worden gedeeld.
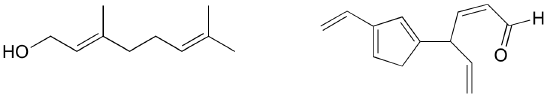
Oefening: Identificeer alle geïsoleerde en geconjugeerde pi bindingen in lycopeen, de roodgekleurde verbinding in tomaten. Hoeveel pi elektronen zitten er in het geconjugeerde pi systeem?
Oplossingen bij oefeningen
Aromaticity – The Ultimate Conjugated System
Moleculaire orbitaaltheorie is vooral nuttig bij het verklaren van de unieke eigenschappen van aromatische verbindingen zoals benzeen:
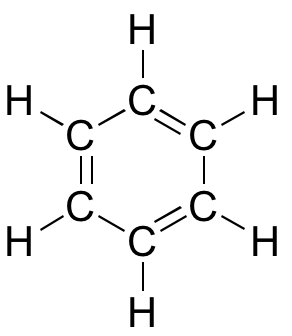
3D interactief model van benzeen
Hoewel benzeen meestal wordt getekend met drie dubbele bindingen en drie enkele bindingen, zijn in feite alle koolstof-koolstofbindingen precies even lang (138 pm). Bovendien zijn de pi bindingen in benzeen beduidend minder reactief dan ‘normale’ pi bindingen, hetzij geïsoleerd, hetzij geconjugeerd. Iets in de structuur van benzeen maakt de pi binding bijzonder stabiel. Dit ‘iets’ heeft een naam: het wordt ‘aromaticiteit’ genoemd.
Wat is precies deze ‘aromatische’ eigenschap die de pi bindingen in benzeen zo stabiel maakt? Het antwoord op deze vraag ligt voor een groot deel in het feit dat benzeen een cyclisch molecuul is waarin alle ringatomen sp2-gehybridiseerd zijn. Hierdoor kunnen de pi elektronen worden gedelokaliseerd in moleculaire banen die zich helemaal rond de ring uitstrekken, boven en onder het vlak. Om dit te laten gebeuren moet de ring natuurlijk wel vlak zijn – anders zouden de p-banen niet goed kunnen overlappen. Benzeen staat inderdaad bekend als een vlak molecuul.
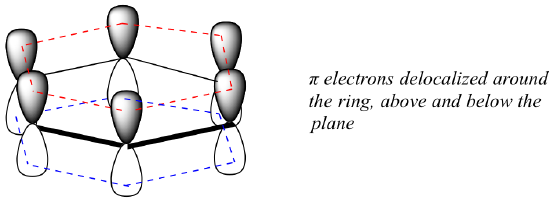
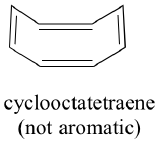
Zijn alle cyclische moleculen met afwisselend enkele en dubbele bindingen even aromatisch stabiel? Het antwoord is in feite “nee”. De acht-ledige cyclooctatetraeenring hieronder is niet plat, en zijn π-bindingen reageren als ‘normale’ alkenen.
Het is duidelijk dat er iets meer nodig is om aromatisch te zijn, en dit kan het best worden verklaard met moleculaire orbitaaltheorie. Laten we eens kijken naar een energiediagram van de pi moleculaire banen in benzeen.
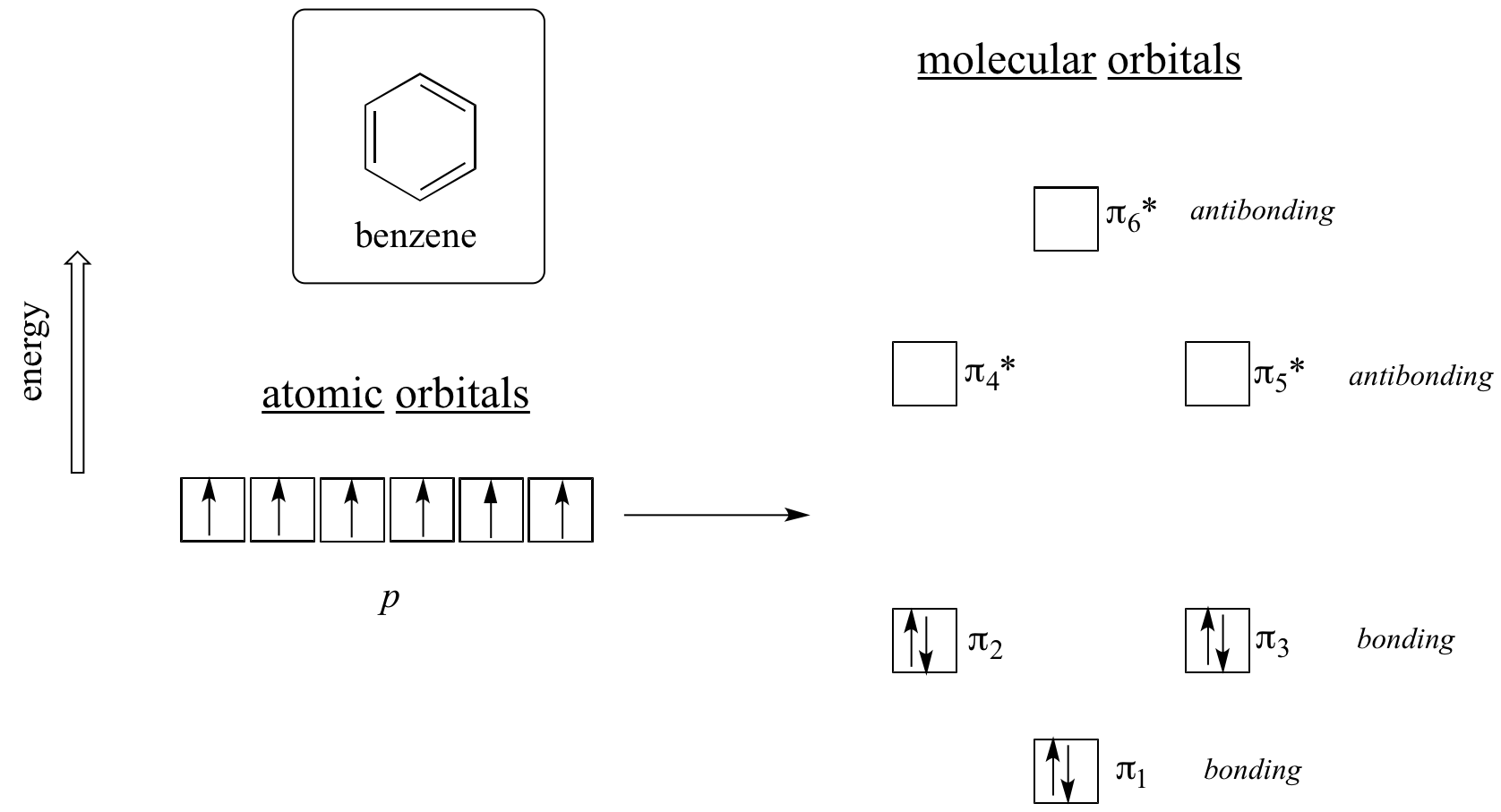
Kwantummechanische berekeningen vertellen ons dat de zes pi moleculaire banen in benzeen, gevormd uit zes atomaire p-banen, vier afzonderlijke energieniveaus bezetten. pi1 en pi6* hebben unieke energieniveaus, terwijl de paren pi2 – pi3 en pi4* – pi5* ontaard zijn, wat betekent dat ze zich op hetzelfde energieniveau bevinden. Als we het aufbau-principe gebruiken om deze banen op te vullen met de zes pi elektronen in benzeen, zien we dat de bindingsbanen volledig gevuld zijn, en de anti-bindingsbanen leeg zijn. Dit geeft ons een goede aanwijzing voor de bron van de bijzondere stabiliteit van benzeen: een volledige set van bindende MO’s is in veel opzichten vergelijkbaar met de ‘volle schil’ van elektronen in de atomaire banen van de stabiele edelgassen helium, neon, en argon.
Nu doen we hetzelfde voor cyclooctatetraeen, waarvan we al hebben geleerd dat het niet aromatisch is.
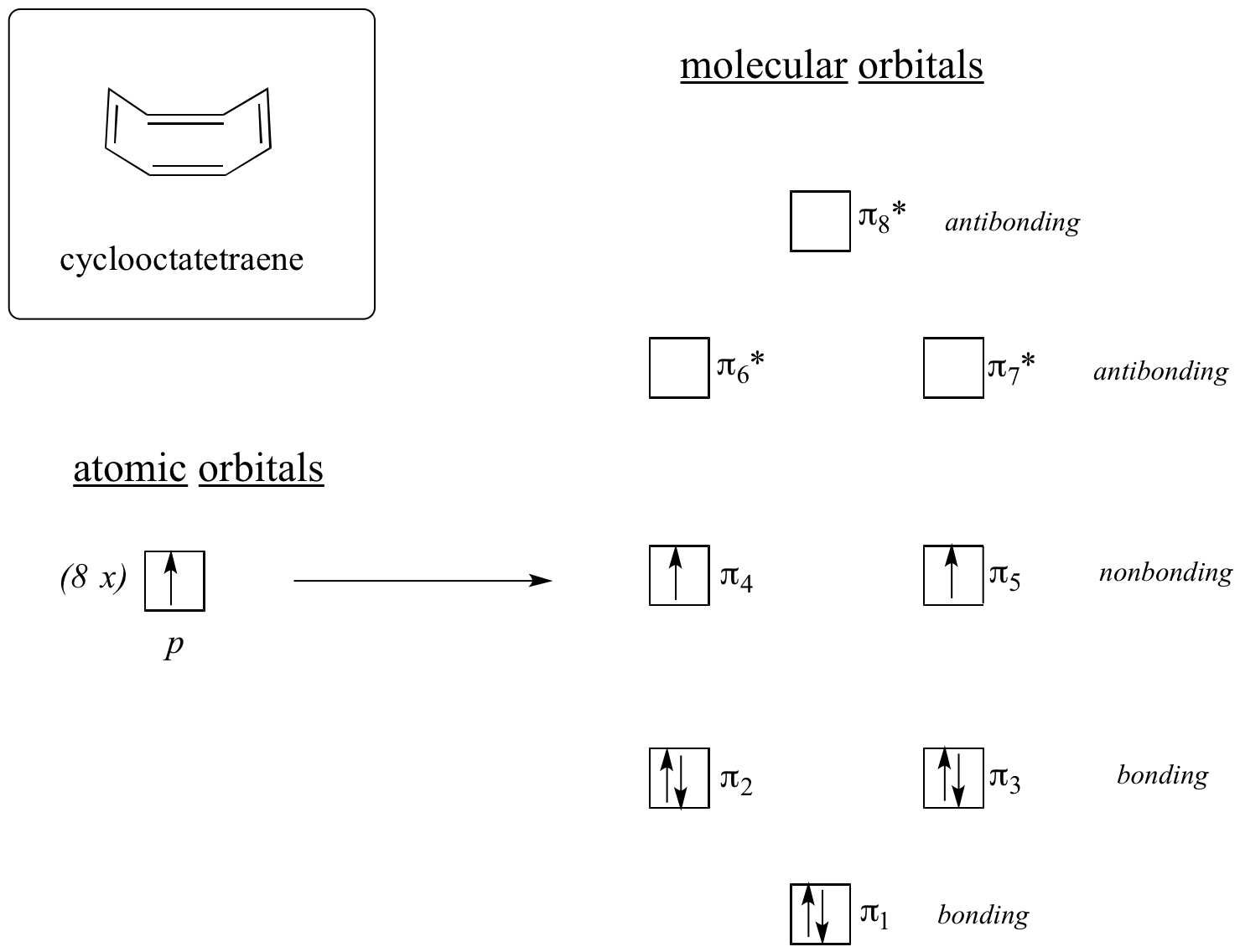
Het resultaat van de moleculaire orbitaalberekeningen leert ons dat de laagste en hoogste energie MO’s (pi1 en pi8*) unieke energieniveaus hebben, terwijl de andere zes degenerate paren vormen. Merk op dat pi4 en pi5 op hetzelfde energieniveau liggen als de geïsoleerde 2pz atoombanen: deze zijn dus noch bindend noch antbindend, maar worden non-bonding MOs genoemd. Als we de MO’s opvullen met de acht pi elektronen in het molecuul, vinden we dat de laatste twee elektronen ongepaard zijn en in de twee ontaarde niet-bondige orbitalen vallen. Omdat we geen perfect gevulde schil van bindende MO’s hebben, is ons molecuul niet aromatisch. Bijgevolg gedraagt elk van de dubbele bindingen in cyclooctatetraeen zich meer als een geïsoleerde dubbele binding.
Voorlopig is het belangrijke leerdoel om geconjugeerde pi bindingsystemen te herkennen en te begrijpen dat benzeen uitzonderlijk stabiel is en een eigenschap vertoont die aromaticiteit wordt genoemd. Aromaticiteit en de chemie van aromatische verbindingen zijn relatief complex en worden in meer detail besproken in de volgende hoofdstukken van deze tekst.
Organische chemie met een biologische nadruk door Tim Soderberg (Universiteit van Minnesota, Morris)