Elektronegativiteit en bindingspolariteit
Hoewel we covalente binding gedefinieerd hebben als het delen van elektronen, worden de elektronen in een covalente binding niet altijd gelijkelijk gedeeld door de twee gebonden atomen. Tenzij de binding twee atomen van hetzelfde element verbindt, zoals in H2, zal er altijd één atoom zijn dat de elektronen in de binding sterker aantrekt dan het andere atoom, zoals in HCl, te zien in figuur 1. Een covalente binding met een gelijke elektronenverdeling (Figuur 1) wordt een apolaire covalente binding genoemd. Een covalente binding met een ongelijke verdeling van elektronen, zoals in Figuur \PageIndex{1b}, wordt een polaire covalente binding genoemd.

De verdeling van de elektronendichtheid in een polaire binding is ongelijk. Ze is groter rond het atoom dat de elektronen meer aantrekt dan het andere. Bijvoorbeeld, de elektronen in de H-Cl binding van een waterstofchloride molecuul brengen meer tijd door in de buurt van het chlooratoom dan in de buurt van het waterstofatoom. Merk op dat het gearceerde gebied rond Cl in figuur {PageIndex{1b}} veel groter is dan rond H.
Dit onevenwicht in elektronendichtheid resulteert in een opbouw van een partiële negatieve lading (aangeduid als δ-) aan de ene kant van de binding (Cl) en een partiële positieve lading (aangeduid als δ+) aan de andere kant van de binding (H). Dit is te zien in figuur δ. De scheiding van lading in een polaire covalente binding resulteert in een elektrische dipool (twee polen), weergegeven door de pijl in figuur (\PageIndex{2b}). De richting van de pijl wijst naar het δ-uiteinde terwijl de + staart van de pijl het δ+ uiteinde van de binding aangeeft.
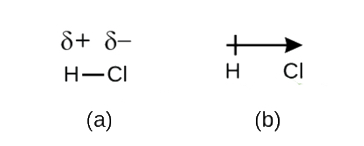
Figuur \(\PageIndex{2}\): (a) Ongelijke verdeling van het elektronenpaar tussen H en Cl leidt tot een gedeeltelijk positieve lading op het H-atoom en een gedeeltelijk negatieve lading op het Cl-atoom. De symbolen δ+ en δ- geven de polariteit van de H-Cl binding aan. (b) De dipool wordt voorgesteld door een pijl met een kruis aan de staart. Het kruis bevindt zich bij het δ+-uiteinde en de pijlpunt valt samen met de δ-.
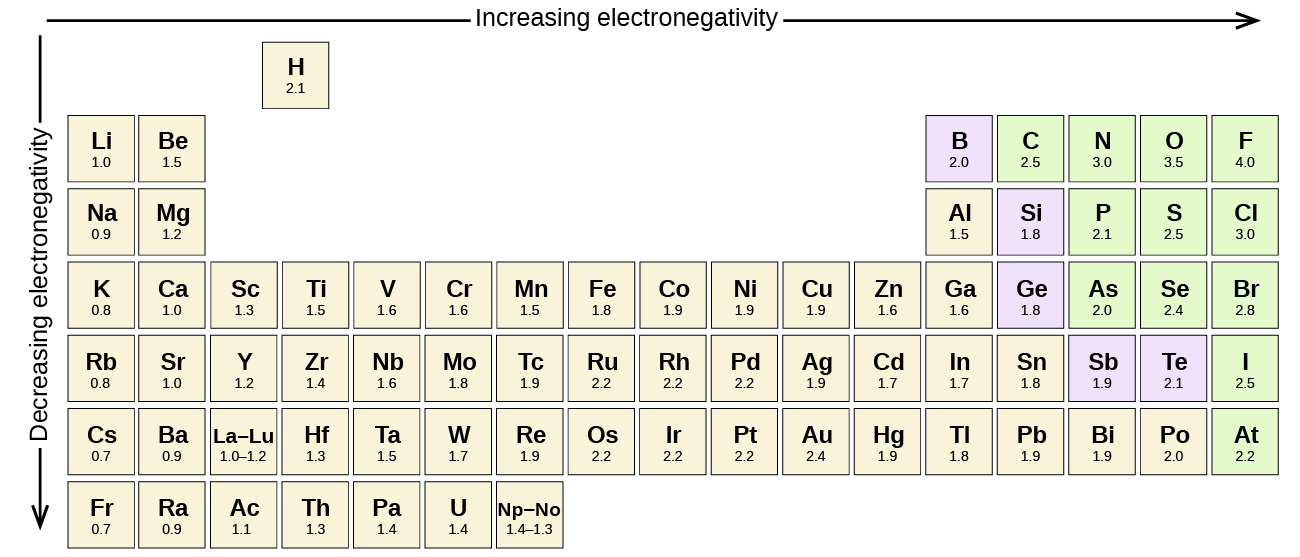
Elke covalente binding tussen atomen van verschillende elementen is een polaire binding, maar de mate van polariteit varieert sterk. Sommige bindingen tussen verschillende elementen zijn slechts minimaal polair, terwijl andere sterk polair zijn. Ionische bindingen kunnen worden beschouwd als het summum van polariteit, waarbij elektronen worden overgedragen in plaats van gedeeld. Om de relatieve polariteit van een covalente binding te beoordelen, gebruiken chemici elektronegativiteit, een relatieve maat voor hoe sterk een atoom elektronen aantrekt wanneer het een covalente binding vormt. Er zijn verschillende numerieke schalen om de elektronegativiteit te beoordelen. Figuur toont een van de populairste – de Pauling-schaal.
Nauwkeuriger kijken: Linus Pauling
Ongetwijfeld de invloedrijkste scheikundige van de 20e eeuw, Linus Pauling (1901-1994), is de enige die twee individuele (dat wil zeggen: niet gedeelde) Nobelprijzen heeft gewonnen. In de jaren 1930 gebruikte Pauling nieuwe wiskundige theorieën om enkele fundamentele principes van de chemische binding te formuleren. Zijn boek The Nature of the Chemical Bond uit 1939 is een van de belangrijkste boeken die ooit in de chemie zijn gepubliceerd.
In 1935 ging Paulings belangstelling uit naar biologische moleculen, en hij kreeg de Nobelprijs voor de Scheikunde in 1954 voor zijn werk aan de proteïnestructuur. (Hij was heel dicht bij de ontdekking van de dubbele helixstructuur van DNA toen James Watson en James Crick in 1953 hun eigen ontdekking van de structuur bekendmaakten). Later kreeg hij de Nobelprijs voor de Vrede 1962 voor zijn inspanningen om het testen van kernwapens te verbieden.

Linus Pauling was een van de invloedrijkste scheikundigen van de 20e eeuw.
In zijn latere jaren raakte Pauling ervan overtuigd dat grote doses vitamine C ziektes, waaronder verkoudheid, zouden voorkomen. De meeste klinische onderzoeken toonden geen verband aan, maar Pauling bleef dagelijks grote doses innemen. Hij stierf in 1994, na een leven lang een wetenschappelijke erfenis te hebben opgebouwd die weinigen ooit zullen evenaren.
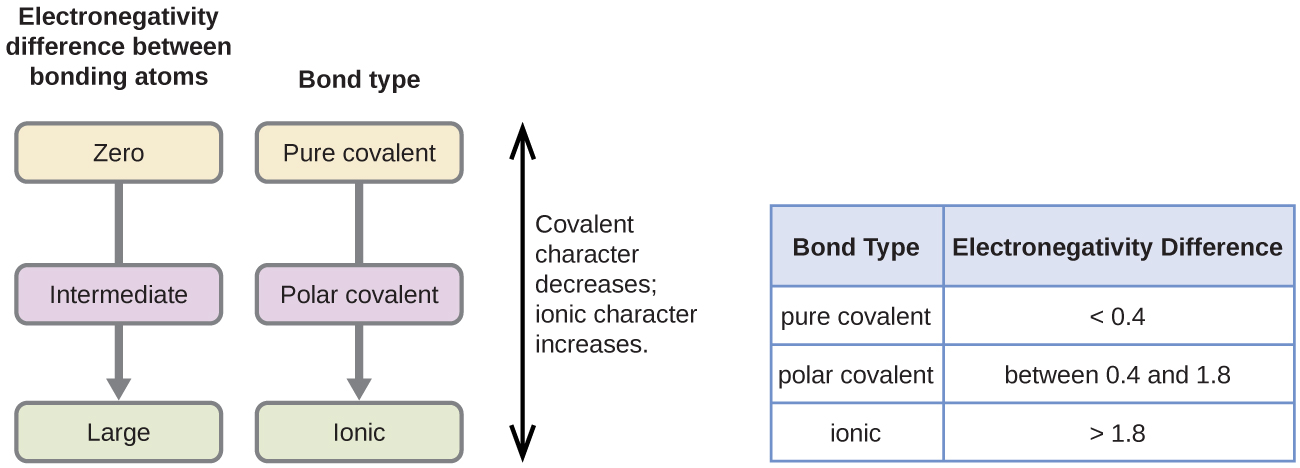
De polariteit van een covalente binding kan worden beoordeeld door het verschil in elektronegativiteiten te bepalen van de twee atomen die de binding aangaan. Hoe groter het verschil in elektronegativiteiten, hoe groter het onevenwicht in de elektronendeling in de binding. Hoewel er geen harde en snelle regels zijn, is de algemene regel dat als het verschil in elektronegativiteiten kleiner is dan ongeveer 0,4, de binding als niet-polair wordt beschouwd; als het verschil groter is dan 0,4, wordt de binding als polair beschouwd. Als het verschil in elektronegativiteiten groot genoeg is (in het algemeen groter dan ongeveer 1,8), wordt de resulterende verbinding als ionisch beschouwd in plaats van covalent. Een elektronegativiteitsverschil van nul duidt natuurlijk op een apolaire covalente binding.
Voorbeeld (\PageIndex{1})
Beschrijf het verschil in elektronegativiteit tussen elk atomenpaar en de resulterende polariteit (of bindtype).
- C en H
- H en H
- Na en Cl
- O en H
Oplossing
- Koolstof heeft een elektronegativiteit van 2,5, terwijl de waarde voor waterstof 2,1 is. Het verschil is 0,4, wat vrij klein is. De C-H-binding wordt daarom als niet-polair beschouwd.
- Beide waterstofatomen hebben dezelfde elektronegativiteitswaarde-2,1. Het verschil is nul, dus de binding is niet polair.
- De elektronegativiteit van natrium is 0,9, die van chloor 3,0. Het verschil is 2,1, wat vrij hoog is, en dus vormen natrium en chloor een ionische verbinding.
- Met 2,1 voor waterstof en 3,5 voor zuurstof, is het verschil in elektronegativiteit 1,4. We zouden een zeer polaire binding verwachten. The sharing of electrons between O and H is unequal with the electrons more strongly drawn towards O.
Exercise \(\PageIndex{1}\)
Describe the electronegativity (EN) difference between each pair of atoms and the resulting polarity (or bond type).
- C and O
- K and Br
- N and N
- Cs and F
Answer a:
The EN difference is 1.0 , hence polar. The sharing of electrons between C and O is unequal with the electrons more strongly drawn towards O.
Answer b:
The EN difference is greater than 1.8, hence ionic.
Answer c:
Identical atoms have zero EN difference, hence nonpolar.
Answer d:
The EN difference is greater than 1.8, hence ionic.