1. Erk signalering overzicht
De extracellulair-signaal-gereguleerde kinase (ERK) route is een van de belangrijkste signaleringscascades van de mitogeen geactiveerde proteïne kinase (MAPK) signaleringsroute. De ERK-cascade wordt geactiveerd door een verscheidenheid van extracellulaire agentia, waaronder groeifactoren, hormonen en ook cellulaire stress om cellulaire processen te induceren die hoofdzakelijk proliferatie en differentiatie omvatten, maar onder sommige omstandigheden ook stressrespons en andere. De belangrijkste MAPK/ERK-kinase-componenten (MEKK) zijn de Raf-familieleden Raf-1, A-Raf en B-Raf, die twee serineresiduen fosforyleren op de MAPK/ERK-kinase-componenten (MEK) MEK1/2. ERK1/2 zijn verantwoordelijk voor het stimuleren van de downstream-effectoren, waarvan er vele transcriptiefactoren zijn. Een van de belangrijkste transcriptiefactoren is het cyclisch-AMP-reactie-element-bindend eiwit (CREB).
Deze ERK-route draagt bij tot de controle van een groot aantal cellulaire processen:
– Regeling van celproliferatie zoals T-cel activering
– Synaptische plasticiteit zoals lange-termijn potentiatie (LTP) in hippocampale neuronen
– Proliferatie van endotheelcellen tijdens angiogenese
– Fosforylering van de transcriptiefactor p53
– Remodellering van de ERK signaleringsroute kan bijdragen aan de ontwikkeling van polycysteuze nierziekte
– Activatie van fosfolipase A2 (PLA2) in mestcellen.
2. Erk signaalcascade
De activering van de ERK1/2 cascade wordt meestal geïnitieerd bij membraanreceptoren, zoals receptor Tyr kinases (RTK’s), G-eiwit gekoppelde receptoren (GPCR’s), ionenkanalen, en andere. Deze receptoren geven het signaal door aan adaptor eiwitten (b.v. Grb2) en uitwisselingsfactoren (b.v. SOS) die op hun beurt de activatie van Ras induceren op de plasma membranen, of membranen van andere organellen. Het geactiveerde, aan GTP gebonden Ras geeft het signaal vervolgens door aan de eiwit-kinasen Raf-1, B-Raf, en A-Raf (Rafs) binnen het MAP3K niveau van deze cascade. Deze activering vindt plaats door Rafs te rekruteren op de membranen, waar zij vervolgens worden gefosforyleerd en geactiveerd. MOS is een andere MAP3K van de ERK-cascade, maar deze functioneert hoofdzakelijk in het voortplantingssysteem door een andere wijze van regulering. Vanaf het MAP3K-niveau wordt het signaal vervolgens via de MAPKK-componenten naar beneden in de cascade doorgegeven: MEK1/2. Zij worden geactiveerd door serinefosforylering aan het MAPKK-typische Ser-Xaa-Ala-Xaa-Ser/Thr-motief in hun activeringslus. Op hun beurt activeren MEK1/2 hun enige bekende substraten, natieve ERK1/2, die fungeren als hun enige downstream targets, wat suggereert dat MEK1/2 dienen als de specificiteitbepalende componenten van de ERK1/2 cascade. MEK1/2 zijn de enige proteïnekinasen met dubbele specificiteit die zowel regulerende Thr als Tyr residuen van ERK1/2 kunnen fosforyleren. Tot op heden zijn ongeveer 200 verschillende substraten van ERK1/2 geïdentificeerd. Deze substraten bevinden zich ofwel in het cytosol (b.v. PLA2 RSK), of na translocatie, in de kern, waaronder transcriptiefactoren zoals Elk1, c-Fos, en c-Jun.
– MAP3K-Raf 1
Raf-1 is de best bestudeerde van de groeifactorsignaleringsmoleculen op het MAP3K-niveau van de cascade. Het is een 70- tot 75-kDa proteïne serine/threonine kinase, dat een kinase domein bevat in de COOH-terminale helft van het molecuul en een regulatoir domein dat de rest van het molecuul inneemt. Bij stimulatie met diverse mitogenen ondergaat Raf-1 binnen 2-3 mm een voorbijgaande activering. Het mechanisme van de activering van Raf-1 is de afgelopen jaren uitvoerig bestudeerd. Het is nu duidelijk dat Raf-1 stroomafwaarts gelegen is van HAS, dat bij stimulatie direct lijkt te interageren met het NH2-terminale deel van Raf-1.
– MAPKK-MEK1/2
De MEK’s vormen een evolutionair geconserveerde familie van proteïne serine/threonine kinasen die tot op heden drie zeer homologe (85%) zoogdier-isovormen omvat. Het mechanisme van MEK-1 activatie impliceert eiwitfosforylatie op enkel serine residu’s en lijkt gelijkaardig te zijn of het nu gefosforyleerd wordt door MEKK, Raf-1, of door autofosforylatie, zoals bepaald door phosphopeptide maps. MAPKKs (MEKs) zijn zeer specifiek voor de downstream componenten ERK-1 en ERK-2. Bovendien herkende MAPKK noch de gedenatureerde vorm van zijn substraat, noch peptiden die de fosforyleringsplaatsen in ERK bevatten, wat erop wijst dat het enzym de natieve vorm van MAPK nodig heeft.
– MAPK-ERK-1/2
Omdat ze zo sterk op elkaar lijken, worden ERK-1 en ERK-2 gewoonlijk beschouwd als functioneel redundant. Het belangrijkste mechanisme dat leidt tot de fosforylering van ERK-1 en -2 op deze beide regulatieresiduen is hun fosforylering door MEK. Door de vrij brede aard van zijn substraatherkenning kunnen de ERK’s na hun activering een groot aantal eiwitten fosforyleren. Deze eiwitten zijn vaak regulerend van aard en bevinden zich zowel in het cytoplasma als in de kern.
3. Downstream signalering van de Erk pathway
– Celproliferatie
Geactiveerd ERK1/2 fosforyleert RSK en zowel RSK als ERK transloceren naar de kern waar ze meerdere transcriptiefactoren zoals CREB, Fos en Elk-1 activeren, wat uiteindelijk resulteert in de synthese van effectoreiwitten en veranderingen in celproliferatie en overleving teweegbrengt. CREB (cAMP response element-binding protein) is een cellulaire transcriptiefactor die de gen-transcriptie meer dan 10 keer kan versterken. c-fos is een eiwit van 380 aminozuren met een basale leucine zipper-regio voor dimerisatie en DNA-binding en een transactiveringsdomein aan de C-terminus. Het is betrokken bij belangrijke cellulaire gebeurtenissen, waaronder celproliferatie, -differentiatie en -overleving; ETS-domein-bevattend eiwit (Elk-1) is een eiwit dat bij de mens wordt gecodeerd door het ELK1-gen. Elk-1 functioneert ook als een transcriptie-activator.
– Oncogenese
ERK1/2 activering bevordert metaplasie en tumorontwikkeling door Bim en Bid te fosforyleren en de proteasoomafbraak van Bim en de sequestratie van Bad naar de fosfoserine-bindende eiwitten te veroorzaken en zo apoptose te remmen. In een afzonderlijke route fosforyleert ERK1/2 activering FOXO3a op Ser 294, Ser 344, en Ser 425 en vergemakkelijkt FOXO3a-MDM2 interactie. Deze interactie bevordert de afbraak van FOXO3a via een MDM2-afhankelijke ubiquitine-proteasoom route, wat leidt tot de ontwikkeling van tumoren.
– Ontwikkeling en Differentiatie
Signalering door receptor tyrosine kinasen die de Ras/Raf/MAP kinase route activeren, reguleert de ontwikkeling en differentiatie van vele soorten cellen. Voornamelijk door de activering van de signaaltransductoren en activatoren van transcriptie-eiwitten (STAT’s).
– Celcyclus
Cdc25 activeert cycline-afhankelijke kinasen door fosfaat te verwijderen uit residuen in de actieve site van Cdk. Het is bekend dat het de overgangen van G1 naar S-fase en van G2 naar M-fase controleert. Erk1/2 kan het Cdc25 eiwit activeren en op zijn beurt de voortgang van de celcyclus bevorderen.
4. Regeling van Erk signalering
De regeling van Erk signalering is zeer belangrijk voor ons om de normale functie van cellen te handhaven. Er zijn meerdere regulatie strategieën voor de cel om de Erk signaleringsroute te reguleren, voornamelijk omvatten regulatie door terugkoppeling lussen, door up-en down stream steigers, door fosfatase en remmers van Erk signaleringsroute.
– Terugkoppeling lussen regulatie
Er zijn verschillende punten van negatieve feedback in de ERK pathway (figuur 1). MEK is één doelwit en kan worden geremd door ERK-fosforylering van MEK1/2 op Thr292 en Thr212. Fosforylering voorkomt verdere verhoging van MEK-activiteit door PAK1 en vermindert daardoor de activering van ERK. Fosforylering van Raf op meerdere plaatsen door ERK biedt een tweede mogelijk terugkoppelingsmechanisme. Hyperfosforylering van deze plaatsen voorkomt Raf-interactie met het Ras GTPase en bevordert de defosforylering ervan door het fosfatase PP2A. De activering of transcriptionele upregulatie van fosfatasen door ERK is een alternatief negatief terugkoppelingsmechanisme. Deze verschillende door ERK geactiveerde negatieve terugkoppelingslussen bieden een middel om de duur van het signaal te beperken en de pathway terug te brengen naar de basale toestand.
– Regulering van Up en Down Stream Scaffolds
Scaffold-eiwitten binden twee of meer componenten van een signaleringspathway om ze in elkaars nabijheid te brengen en zo hun functionele interactie te vergemakkelijken. Bovendien kunnen scaffolds deze multi-enzym signaleringsmodules naar verschillende cellulaire locaties brengen en daardoor de fosforylering van een specifieke subset van down-stream substraten versterken. Scaffolds beïnvloeden ook de duur van het signaal, voorkomen overspraak tussen gelijksoortige pathways, en kunnen de activering van de signaleringsmodule koppelen aan een specifiek stroomopwaarts activerend signaal.
– Fosfatase en remmers
De activiteit van de MAPK pathways wordt bepaald door de concurrerende acties van stroomopwaartse kinases en remmende fosfatases. De MAPK-banen worden beëindigd door de defosforylering van hun componenten door verscheidene fosfatasen. Van verschillende serine/threonine fosfatasen, zoals PP2A en PP2Ca, en tyrosine fosfatasen, zoals PTP-SL en HePTP, is aangetoond dat ze MAPK’s inactiveren.
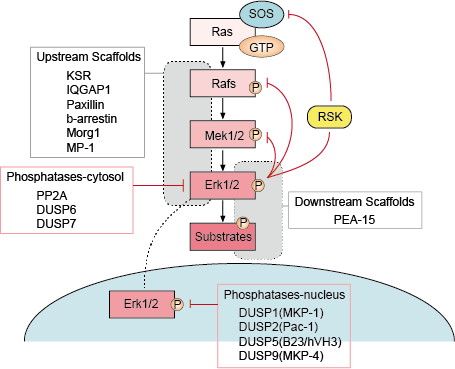
Figuur 1. Regeling van de Erk-signaleringsroute
5. Relatie met ziekten
In overeenstemming met hun cruciale rol in belangrijke cellulaire activiteiten, waaronder celproliferatie, -differentiatie, en -overleving of -dood, zijn de MAPK-signaalwegen betrokken bij de pathogenese van vele ziekten bij de mens.
– De ziekte van Alzheimer
Alzheimer (AD) is een neurodegeneratieve ziekte die wordt gekenmerkt door cognitieve stoornissen en geheugenstoornissen die vermoedelijk het gevolg zijn van de vorming in de hersenen van zowel seniele plaques die amyloid-β (Aβ) bevatten als neurofibrillaire tangles die het microtubule-geassocieerde eiwit tau bevatten. Er zijn dus aanwijzingen dat MAPK-signaalwegen kunnen bijdragen aan de pathogenese van AD door de regulatie van neuronale apoptose, β- en γ-secretase activiteit, en fosforylering van APP en tau.
– Ziekte van Parkinson
De ziekte van Parkinson (PD) is de tweede meest voorkomende neurodegeneratieve ziekte. Verschillende waarnemingen suggereren dat MAPK signaalwegen bijdragen aan neuro-inflammatoire reacties en neuronale sterfte veroorzaakt door α-synucleïne aggregaten of functionele tekorten in parkine of DJ-1 in de pathogenese van de ziekte van Parkinson.
– MAPK signalering in kanker
Veel van de kanker-geassocieerde mutaties van componenten van MAPK signaalwegen zijn gevonden in Ras en B-Raf, die beide deelnemen aan de ERK signaalweg. De ERK signaleringsroute speelt een rol in verschillende stappen van tumorontwikkeling. De fosforylering door ERK van eiwitten zoals myosine lichte keten kinase, calpain, focaal adhesie kinase, en paxilline bevordert de migratie van kankercellen. Verder reguleert ERK1/2 signalering de activiteiten en niveaus van Bcl-2 familie eiwitten, zoals het pro-apoptotische eiwit BIM en het anti-apoptotische eiwit MCL-1, waardoor de overleving van kankercellen wordt bevorderd.
| Keshet Y, Seger R. The MAP kinase signaling cascades: a system of hundreds of components regulates a diverse array of physiological functions. MAP Kinase Signaling Protocols: Second Edition, 2010: 3-38. | |
| Wortzel I, Seger R. The ERK cascade distinct functions within various subcellular organelles. Genes & cancer, 2011, 2(3): 195-209. | |
| Ramos J W. The regulation of extracellular signal-regulated kinase (ERK) in mammalian cells. The international journal of biochemistry & cell biology, 2008, 40(12): 2707-2719. | |
| Shaul Y D, Seger R. The MEK/ERK cascade: from signaling specificity to diverse functions. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2007, 1773(8): 1213-1226. | |
| Yao Z, Seger R. The ERK signaling cascade—views from different subcellular compartments. Biofactors, 2009, 35(5): 407-416. |