Een atoom waar vier groepen aan vastzitten kan ook een tetrahedrale geometrie aannemen. Deze geometrie komt vaak voor wanneer het centrale atoom iets kleiner is. Een tetrahedrale geometrie zorgt ervoor dat naburige groepen iets verder van elkaar kunnen komen te staan.
In tegenstelling tot vierkant-planaire verbindingen hebben eenvoudige tetrahedrale verbindingen niet dezelfde soort cis- en trans-isomeren. Dat wil zeggen, twee groepen kunnen niet zo op een tetraëder worden geplaatst dat ze tegenover elkaar of naast elkaar liggen. De verhouding tussen twee willekeurige groepen op een tetraëder is dezelfde als de verhouding tussen twee willekeurige andere groepen op een tetraëder.
Dichloordimethylsilaan is een verbinding die kan worden gebruikt om siliconenpolymeren te maken. Net als platine heeft het elk twee groepen aan het centrale atoom. De centrale tom is echter tetrahedraal. There is only one way to arrange these four groups.
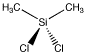
Figure SC3.1. A tetrahedral atom with two different types of groups attached, (CH3)2SiCl2.
However, if four different groups are attached to a tetrahedral atom, the four groups can be arranged in two possible ways. The two compounds that result are mirror images of each other. These two isomers are called enantiomers.
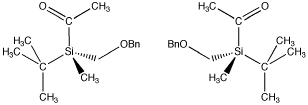
Figure SC3.2. A pair of enantiomers. The (-) enantiomer is on the left and the (+) enantiomer is on the right. Merk op dat aan het tetrahedrale siliciumatoom vier verschillende groepen vastzitten.
- Enantiomeren zijn paren verbindingen met precies dezelfde connectiviteit maar tegengestelde driedimensionale vormen.
- Enantiomeren zijn niet hetzelfde als elkaar; het ene enantiomeer kan niet over het andere heen gelegd worden.
- Enantiomeren zijn spiegelbeelden van elkaar.
Twee verbindingen met exact dezelfde verbinding, die spiegelbeelden van elkaar zijn, maar die niet identiek zijn aan elkaar, worden enantiomeren genoemd. De meer gangbare definitie van een enantiomeer is dat het niet superponeerbaar is op zijn spiegelbeeld. Het kan gemakkelijk worden onderscheiden van zijn spiegelbeeld, net zoals een rechterhand gemakkelijk kan worden geïdentificeerd en onderscheiden van een linkerhand.
- Compounds die in deze paren voorkomen worden “chiraal” genoemd.
- “Chiraal” komt van het Griekse woord voor “hand”.
Met behulp van groepentheorie, de wiskunde van de symmetrie, kan worden aangetoond dat een enantiomeer ook kan worden gedefinieerd als een molecuul dat geen spiegelvlak bevat, wat betekent dat het niet in twee identieke en tegenovergestelde helften kan worden verdeeld.
- Enantiomeren bevatten geen spiegelvlakken.
- Enantiomeren bevatten geen twee gelijke en tegengestelde helften.
In tegenstelling tot cis- en trans-isomeren hebben twee enantiomeren dezelfde fysische eigenschappen. ze hebben hetzelfde smeltpunt, dezelfde oplosbaarheid, enzovoort. Twee verbindingen die bijna identiek zijn, maar spiegelbeelden van elkaar, hebben precies dezelfde intermoleculaire aantrekkingskracht, dus is het geen verrassing dat hun fysische eigenschappen identiek zijn.
- Enantiomeren zijn een ander voorbeeld van een type stereoisomeren.
- Twee enantiomeren hebben identieke fysische eigenschappen, behalve optische draaiing.
Optische draaiing betreft de interactie van vlak gepolariseerd licht met een materiaal. Als een materiaal niet symmetrisch is, zal het licht dat er doorheen gaat, worden gedraaid. Dat betekent dat als de golven waaruit het licht bestaat in één richting oscilleren wanneer zij het materiaal binnengaan, zij enigszins gekanteld zullen zijn om in een andere richting te oscilleren wanneer zij uit het materiaal komen. We zullen dit verschijnsel later bekijken.
- Twee enantiomeren hebben een gelijk maar tegengesteld rotatie-effect op vlak gepolariseerd licht.
- (+) enantiomeren roteren licht met de klok mee.
- (-) enantiomers rotate light in a counterclockwise direction.
For example, in the chiral silicon compound shown above, the (+) enantiomer rotates plane-polarized light in a clockwise direction. It has a “standard optical rotation” of = +12 (+/-2)o. The (-) enantiomer rotates plane-polarized light in a counterclockwise direction. It has a “standard optical rotation” of = -9.9 (+/-2)o.
Problem SC3.1.
A certain compound exists in two forms; enantiomer A and enantiomer B. Enantiomer A has a molecular weight of 126 g/mol, a density of 0.995 g/mL, an optical rotation of = 26o, a melting point of 65 oC, a boiling point of 225 oC, and an odour of citrus fruit. What can you say about the corresponding properties of enantiomer B?
Contributors
-
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)