Berekenen van Graden van Onverzadiging (DoU)
Graad van Onverzadiging (DoU) is ook bekend als Dubbele Binding Equivalent. Als de molecuulformule is gegeven, kunt u de getallen in deze formule invoeren:
- (C) is het aantal koolwaterstoffen
- (N) is het aantal nitrogenen
- (X) is het aantal halogenen (F, Cl, Br, I)
- (H) is het aantal hydrogenen
Zoals eerder gezegd, bevat een verzadigd molecuul alleen enkele bindingen en geen ringen. Een andere manier om dit te interpreteren is dat een verzadigd molecuul het maximaal mogelijke aantal waterstofatomen heeft om een acyclisch alkaan te zijn. Het aantal waterstofatomen kan dus worden weergegeven door 2C+2, wat de algemene moleculaire weergave van een alkaan is. Als voorbeeld: voor de molecuulformule C3H4 is het aantal werkelijke waterstofatomen dat nodig is om de verbinding verzadigd te laten zijn, 8 . De verbinding heeft 4 extra hydrogenen nodig om volledig verzadigd te zijn (verwacht aantal hydrogenen-waargenomen aantal hydrogenen=8-4=4). De onverzadigingsgraad is gelijk aan 2, ofwel de helft van het aantal waterstofgenen dat het molecuul nodig heeft om als verzadigd te worden geclassificeerd. Vandaar dat de DoB-formule deelt door 2. De formule trekt het aantal X’en af omdat een halogeen (X) een waterstof in een verbinding vervangt. Bijvoorbeeld, in chloroethaan, C2H5Cl, is er één waterstof minder vergeleken met ethaan, C2H6.
Om een verbinding verzadigd te laten zijn, is er één waterstof meer in een molecuul als er stikstof aanwezig is. Daarom voegen we het aantal nitrogenen (N) toe. Dit is te zien bij C3H9N vergeleken met C3H8. Zuurstof en zwavel zijn niet in de formule opgenomen omdat de verzadiging niet wordt beïnvloed door deze elementen. As seen in alcohols, the same number of hydrogens in ethanol, C2H5OH, matches the number of hydrogens in ethane, C2H6.
The following chart illustrates the possible combinations of the number of double bond(s), triple bond(s), and/or ring(s) for a given degree of unsaturation. Each row corresponds to a different combination.
- One degree of unsaturation is equivalent to 1 ring or 1 double bond (1 \( \pi \) bond).
- Two degrees of unsaturation is equivalent to 2 double bonds, 1 ring and 1 double bond, 2 rings, or 1 triple bond (2 \( \pi \) bonds).
|
DoU
|
Possible combinations of rings/ bonds
|
||
|---|---|---|---|
|
|
# of rings
|
# of double bonds
|
# of triple bonds
|
|
1
|
1
|
0
|
0
|
|
|
0
|
1
|
0
|
|
2
|
2
|
0
|
0
|
|
|
0
|
2
|
0
|
|
|
0
|
0
|
1
|
|
|
1
|
1
|
0
|
| 3 | 3 | 0 | 0 |
| 2 | 1 | 0 | |
| 1 | 2 | 0 | |
| 0 | 1 | 1 | |
| 0 | 3 | 0 | |
| 1 | 0 | 1 | |
Remember, de onverzadigingsgraad geeft alleen de som van dubbele bindingen, drievoudige bindingen en/of ringen. Bijvoorbeeld, een onverzadigingsgraad van 3 kan 3 ringen, 2 ringen+1 dubbele binding, 1 ring+2 dubbele bindingen, 1 ring+1 drievoudige binding, 1 dubbele binding+1 drievoudige binding, of 3 dubbele bindingen bevatten.
Voorbeeld: Benzeen
Wat is de mate van onverzadigdheid van benzeen?
Oplossing
De molecuulformule voor benzeen is C6H6. Dus,
DoU= 4, waarbij C=6, N=0,X=0, en H=6. 1 DoB kan gelijk zijn aan 1 ring of 1 dubbele binding. Dit komt overeen met benzeen dat 1 ring en 3 dubbele bindingen bevat.
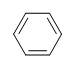
Hoewel, wanneer de molecuulformule C6H6 gegeven wordt, is benzeen slechts een van de vele mogelijke structuren (isomeren). De volgende structuren hebben allemaal een DoB van 4 en hebben dezelfde molecuulformule als benzeen.