Inleiding
Ionische binding is de volledige overdracht van valentie-elektron(en) tussen atomen. Het is een type van chemische binding die twee tegengesteld geladen ionen genereert. In ionische bindingen verliest het metaal elektronen om een positief geladen kation te worden, terwijl het niet-metaal die elektronen aanvaardt om een negatief geladen anion te worden. Ionische bindingen vereisen een elektrondonor, vaak een metaal, en een elektronenacceptor, een niet-metaal.
Ionische bindingen worden waargenomen omdat metalen weinig elektronen in hun buitenste banen hebben. Door deze elektronen kwijt te raken, kunnen deze metalen een edelgasconfiguratie bereiken en voldoen aan de octetregel. Evenzo hebben niet-metalen die bijna 8 elektronen in hun valentieschil hebben, de neiging gemakkelijk elektronen te aanvaarden om de edelgasconfiguratie te bereiken. In ionische bindingen kan meer dan 1 elektron worden afgestaan of ontvangen om aan de octetregel te voldoen. De ladingen van het anion en kation komen overeen met het aantal geschonken of ontvangen elektronen. In ionische bindingen moet de netto lading van de verbinding nul zijn.
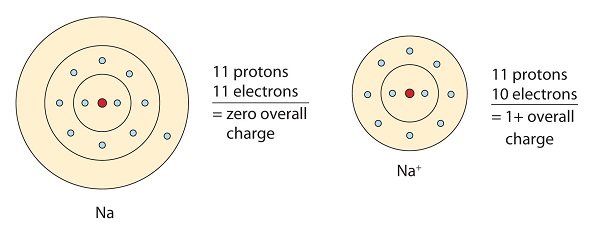
Dit natriummolecuul doneert het eenzame elektron in zijn valentie orbitaal om de octet configuratie te bereiken. Door het verlies van elektronen ontstaat een positief geladen kation.
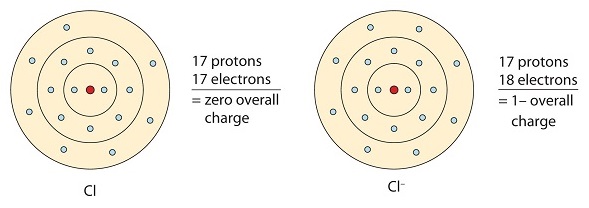
Dit chlooratoom ontvangt één elektron om de octetconfiguratie te bereiken, waardoor een negatief geladen anion ontstaat.
De voorspelde totale energie van het ionische bindingsproces, waarin de ionisatie-energie van het metaal en de elektronenaffiniteit van het niet-metaal zijn opgenomen, is meestal positief, wat aangeeft dat de reactie endotherm en ongunstig is. Deze reactie is echter zeer gunstig door de elektrostatische aantrekkingskracht tussen de deeltjes. Bij de ideale interatomaire afstand komt door de aantrekkingskracht tussen deze deeltjes voldoende energie vrij om de reactie te vergemakkelijken. De meeste ionische verbindingen hebben de neiging te dissociëren in polaire oplosmiddelen omdat ze vaak polair zijn. Dit verschijnsel is het gevolg van de tegengestelde ladingen op elk ion.
Voorbeeld: Chloridezouten
.jpg?revision=2)
In dit voorbeeld staat het natriumatoom zijn 1 valentie-elektron af aan het chlooratoom. Hierdoor ontstaat een natriumkation en een chlooranion. Merk op dat de netto lading van de resulterende verbinding 0 is.
.jpg?revision=2)
In dit voorbeeld staat het magnesiumatoom zijn beide valentie-elektronen af aan de chlooratomen. Elk chlooratoom kan slechts 1 elektron accepteren voordat het zijn edelgasconfiguratie kan bereiken; daarom zijn er 2 chlooratomen nodig om de 2 elektronen te accepteren die door het magnesium zijn afgestaan. Notice that the net charge of the compound is 0.