- Leerdoelen
- B cel productie en rijping
- Denk er eens over
- B-Cel Receptoren
- Denk er eens over
- T-celonafhankelijke activatie van B-cellen
- Denk er eens over
- T-celafhankelijke activering van B-cellen
- Denk er eens over
- Primaire en secundaire reacties
- Denk er eens over
- Key Concepts and Summary
- Meerkeuze
- Fill in the Blank
- Think about It
Leerdoelen
- Beschrijf de productie en rijping van B-cellen
- Vergelijk de structuur van B-celreceptoren en T-celreceptoren
- Vergelijk de T-afhankelijke en T-onafhankelijke activering van B-cellen
- Vergelijk de primaire en secundaire antilichaamresponsen
Humorale immuniteit verwijst naar mechanismen van de adaptieve immuunafweer die worden gemedieerd door antilichamen die door B-lymfocyten worden afgescheiden, of B-cellen. Dit gedeelte zal zich richten op B cellen en hun productie en rijping, receptoren, en mechanismen van activering bespreken.
B cel productie en rijping
Zoals T cellen, worden B cellen gevormd uit multipotente hematopoietische stamcellen (HSCs) in het beenmerg en volgen een pad via lymfoïde stamcel en lymfoblast (zie Figuur 1 in Cellulaire afweer). In tegenstelling tot T-cellen verlaten lymfoblasten die bestemd zijn om B-cellen te worden, het beenmerg niet om naar de thymus te gaan voor maturatie. In plaats daarvan blijven de uiteindelijke B-cellen rijpen in het beenmerg.
De eerste stap van de rijping van B-cellen is een beoordeling van de functionaliteit van hun antigeen-bindende receptoren. Dit gebeurt door positieve selectie voor B-cellen met normale functionele receptoren. Vervolgens wordt een mechanisme van negatieve selectie gebruikt om zelfreagerende B-cellen te elimineren en het risico van auto-immuniteit tot een minimum te beperken. Negatieve selectie van zelfreagerende B-cellen kan bestaan uit eliminatie door apoptose, bewerking of modificatie van de receptoren zodat ze niet langer zelfreactief zijn, of inductie van anergie in de B-cel. Onrijpe B-cellen die de selectie in het beenmerg doorstaan, gaan vervolgens naar de milt voor hun laatste rijpingsstadia. Daar worden zij naïeve rijpe B-cellen, d.w.z, rijpe B-cellen die nog niet geactiveerd zijn.
Denk er eens over
- Vergelijk de rijping van B-cellen met de rijping van T-cellen.
B-Cel Receptoren
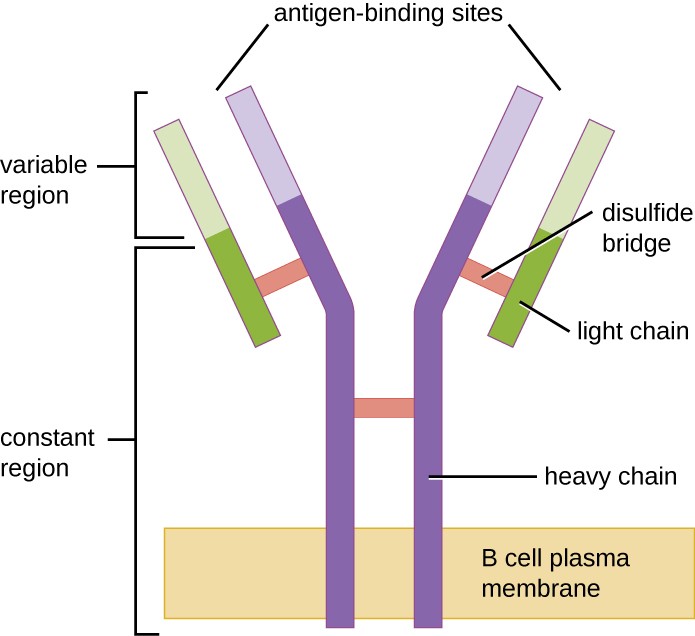
Figuur 1. B-celreceptoren zijn ingebed in de membranen van B-cellen. De variabele regio’s van alle receptoren op één cel binden hetzelfde specifieke antigeen.
Zoals T-cellen bezitten ook B-cellen antigeenspecifieke receptoren met uiteenlopende specificiteiten. Hoewel zij afhankelijk zijn van T-cellen voor een optimale functie, kunnen B-cellen worden geactiveerd zonder hulp van T-cellen. B-celreceptoren (BCR’s) voor naïeve rijpe B-cellen zijn membraangebonden monomere vormen van IgD en IgM. Zij bestaan uit twee identieke zware ketens en twee identieke lichte ketens die door disulfidebindingen verbonden zijn tot een “Y”-basisvorm (figuur 1). De romp van het Y-vormige molecuul, de constante regio van de twee zware ketens, omspant het B-celmembraan. De twee antigeen-bindingsplaatsen aan de buitenkant van de B-cel zijn betrokken bij de binding van specifieke pathogeen-epitopen om het activeringsproces op gang te brengen. Geschat wordt dat elke naïeve rijpe B-cel meer dan 100.000 BCR’s op zijn membraan heeft, en elk van deze BCR’s heeft een identieke epitoop-bindende specificiteit.
Om voorbereid te zijn om te reageren op een breed scala van microbiële epitopen, gebruiken B-cellen, net als T-cellen, genetische herschikking van honderden gensegmenten om de noodzakelijke diversiteit van receptor-specificiteiten te verschaffen. De variabele regio van de zware keten van het BCR bestaat uit V-, D- en J-segmenten, vergelijkbaar met de β-keten van het TCR. De variabele regio van de lichte keten van het BCR bestaat uit V- en J-segmenten, vergelijkbaar met de α-keten van het TCR. Genetische herschikking van alle mogelijke combinaties van V-J-D (zware keten) en V-J (lichte keten) levert miljoenen unieke antigeen-bindende plaatsen op voor het BCR en voor de antilichamen die na activering worden afgescheiden.
Een belangrijk verschil tussen BCR’s en TCR’s is de manier waarop zij kunnen interageren met antigene epitopen. Terwijl TCR’s alleen kunnen interageren met antigene epitopen die worden gepresenteerd binnen de antigeen-bindende kloof van MHC I of MHC II, hebben BCR’s geen antigeen-presentatie met MHC nodig; zij kunnen interageren met epitopen op vrije antigenen of met epitopen die worden weergegeven op het oppervlak van intacte pathogenen. Een ander belangrijk verschil is dat TCR’s alleen eiwit-epitopen herkennen, terwijl BCR’s epitopen kunnen herkennen die geassocieerd zijn met verschillende moleculaire klassen (b.v. eiwitten, polysacchariden, lipopolysacchariden).
Activering van B-cellen vindt plaats via verschillende mechanismen, afhankelijk van de moleculaire klasse van het antigeen. Activering van een B-cel door een eiwitantigeen vereist dat de B-cel als een APC functioneert, die de eiwit-epitopen met MHC II aan helper-T-cellen presenteert. Wegens hun afhankelijkheid van T-cellen voor de activering van B-cellen worden eiwitantigenen geclassificeerd als T-afhankelijke antigenen. Polysacchariden, lipopolysacchariden en andere niet-eiwitantigenen worden daarentegen beschouwd als T-onafhankelijke antigenen, omdat ze B-cellen kunnen activeren zonder antigeenverwerking en presentatie aan T-cellen.
Denk er eens over
- Welke typen moleculen fungeren als BCR?
- Wat zijn de verschillen tussen TCR’s en BCR’s met betrekking tot antigeenherkenning?
- Welke molecuulklassen zijn T-afhankelijke antigenen en welke T-onafhankelijke antigenen?
T-celonafhankelijke activatie van B-cellen
Activatie van B-cellen zonder de medewerking van helper-T-cellen wordt T-celonafhankelijke activatie genoemd en treedt op wanneer BCR’s interageren met T-onafhankelijke antigenen. T-onafhankelijke antigenen (bv. polysaccharidekapsels, lipopolysaccharide) hebben repetitieve epitope-eenheden in hun structuur, en deze herhaling maakt de cross-linkage van meerdere BCR’s mogelijk, wat het eerste signaal voor activering oplevert (figuur 2). Omdat er geen T-cellen bij betrokken zijn, moet het tweede signaal van andere bronnen komen, zoals interacties van toll-like receptoren met PAMP’s of interacties met factoren van het complementsysteem.
Als een B-cel eenmaal geactiveerd is, ondergaat hij een klonale proliferatie en de dochtercellen differentiëren zich tot plasmacellen. Plasmacellen zijn antilichaamfabrieken die grote hoeveelheden antilichamen afscheiden. Na differentiatie verdwijnen de BCR’s aan het oppervlak en scheidt de plasmacel pentamere IgM-moleculen af die dezelfde antigeenspecificiteit hebben als de BCR’s (figuur 2).
De T-celonafhankelijke respons is van korte duur en resulteert niet in de productie van geheugen-B-cellen. Zij leidt dus niet tot een secundaire reactie op latere blootstellingen aan T-onafhankelijke antigenen.

Figuur 2. T-onafhankelijke antigenen hebben zich herhalende epitopen die B-celherkenning en -activering kunnen induceren zonder tussenkomst van T-cellen. Een tweede signaal, zoals interactie van TLR’s met PAMP’s (niet afgebeeld), is ook vereist voor activering van de B-cel. Eenmaal geactiveerd, prolifereert de B-cel en differentieert in antilichaam-afscheidende plasmacellen.
Denk er eens over
- Wat zijn de twee signalen die nodig zijn voor T-celonafhankelijke activatie van B-cellen?
- Wat is de functie van een plasmacel?
T-celafhankelijke activering van B-cellen

Figuur 3. Klik voor een grotere afbeelding. Bij T-celafhankelijke activering van B-cellen herkent en internaliseert de B-cel een antigeen en presenteert dit aan een helper-T-cel die specifiek is voor hetzelfde antigeen. De helper-T-cel treedt in wisselwerking met het door de B-cel aangeboden antigeen, waardoor de T-cel wordt geactiveerd en het vrijkomen van cytokinen wordt gestimuleerd, die vervolgens de B-cel activeren. Activering van de B-cel leidt tot proliferatie en differentiatie in B-cellen en plasmacellen.
T-cel-afhankelijke activering van B-cellen is complexer dan T-cel-onafhankelijke activering, maar de resulterende immuunrespons is sterker en ontwikkelt geheugen. T-celafhankelijke activering kan optreden als reactie op vrije eiwitantigenen of op eiwitantigenen die geassocieerd zijn met een intact pathogeen. Interactie tussen de BCR’s op een naïeve rijpe B-cel en een vrij eiwitantigeen stimuleert de internalisatie van het antigeen, terwijl interactie met antigenen geassocieerd met een intact pathogeen de extractie van het antigeen uit het pathogeen initieert vóór de internalisatie. Eenmaal geïnternaliseerd in de B-cel, wordt het eiwitantigeen verwerkt en gepresenteerd met MHC II. Het gepresenteerde antigeen wordt vervolgens herkend door helper-T-cellen die specifiek zijn voor hetzelfde antigeen. De TCR van de helper-T-cel herkent het vreemde antigeen, en het CD4-molecuul van de T-cel interageert met MHC II op de B-cel. De coördinatie tussen B-cellen en helper T-cellen die specifiek zijn voor hetzelfde antigeen wordt gekoppelde herkenning genoemd.
Eenmaal geactiveerd door gekoppelde herkenning, produceren en scheiden TH2-cellen cytokines af die de B-cel activeren en een proliferatie in klonale dochtercellen veroorzaken. Na een aantal proliferatierondes stimuleren extra cytokines, geleverd door de TH2-cellen, de differentiatie van geactiveerde B-celklonen in geheugen-B-cellen, die snel zullen reageren op volgende blootstellingen aan hetzelfde eiwit-epitoop, en plasmacellen die hun membraan BCR’s verliezen en aanvankelijk pentamerisch IgM uitscheiden (figuur 3).
Na de initiële secretie van IgM stimuleren cytokinen, afgescheiden door TH2-cellen, de plasmacellen om over te schakelen van IgM-productie op de productie van IgG, IgA, of IgE. Dit proces, dat klasse- of isotype-switching wordt genoemd, maakt het mogelijk dat plasmacellen, gekloond uit dezelfde geactiveerde B-cel, een verscheidenheid van antilichaamklassen met dezelfde epitoopspecificiteit produceren. Klasseverandering wordt bereikt door genetische herschikking van gensegmenten die coderen voor de constante regio, die de klasse van een antilichaam bepaalt. De variabele regio wordt niet veranderd, zodat de nieuwe antilichaamklasse de oorspronkelijke epitoopspecificiteit behoudt.
Denk er eens over
- Welke stappen zijn nodig voor T-cel-afhankelijke activering van B-cellen?
- Wat is antilichaamklasse-switching en waarom is het belangrijk?
Primaire en secundaire reacties
T-celafhankelijke activering van B-cellen speelt een belangrijke rol in zowel de primaire als de secundaire reacties die geassocieerd worden met adaptieve immuniteit. Bij de eerste blootstelling aan een eiwitantigeen treedt een T-celafhankelijke primaire antilichaamrespons op. De eerste fase van de primaire respons is een latente periode van ongeveer 10 dagen, waarin geen antilichaam in serum kan worden aangetoond. Deze latente periode is de tijd die nodig is voor alle stappen van de primaire respons, waaronder naïeve rijpe B-celbinding van antigeen met BCR’s, antigeenverwerking en -presentatie, helper-T-celactivering, B-celactivering, en klonale proliferatie. Het einde van de lageperiode wordt gekenmerkt door een stijging van de IgM-spiegel in het serum, wanneer TH2-cellen de differentiatie van B-cellen tot plasmacellen stimuleren. De IgM-spiegels bereiken hun piek ongeveer 14 dagen na de blootstelling aan een primair antigeen; ongeveer op hetzelfde ogenblik stimuleert TH2 de omschakeling naar een andere antilichaamklasse, en de IgM-spiegels in het serum beginnen te dalen. Intussen neemt het IgG-gehalte toe tot het ongeveer drie weken na de primaire reactie een piek bereikt (figuur 4).
Tijdens de primaire reactie worden sommige van de gekloonde B-cellen gedifferentieerd tot geheugen-B-cellen die zijn geprogrammeerd om te reageren op latere blootstellingen. Deze secundaire reactie treedt sneller en krachtiger op dan de primaire reactie. De vertragingsperiode is teruggebracht tot slechts enkele dagen en de productie van IgG is aanzienlijk hoger dan die van de primaire respons (figuur 4). Bovendien zijn de tijdens de secundaire reactie geproduceerde antilichamen doeltreffender en binden zij zich met een hogere affiniteit aan de beoogde epitopen. Plasmacellen die tijdens secundaire reacties worden geproduceerd, leven langer dan die welke tijdens de primaire reactie worden geproduceerd, zodat de niveaus van specifieke antilichamen gedurende langere tijd verhoogd blijven.

Figuur 4. Vergeleken met de primaire reactie treedt de secundaire antilichaamrespons sneller op en produceert deze een hoger en langduriger antilichaamniveau. Bij de secundaire reactie gaat het meestal om IgG.
Denk er eens over
- Welke gebeurtenissen doen zich voor tijdens de vertragingsperiode van de primaire antilichaamrespons?
- Waarom blijven antilichaamspiegels langer verhoogd tijdens de secundaire antilichaamrespons?
Key Concepts and Summary
- B-lymfocyten of B-cellen produceren antilichamen die betrokken zijn bij humorale immuniteit. B-cellen worden geproduceerd in het beenmerg, waar de eerste stadia van rijping plaatsvinden, en gaan naar de milt voor de laatste stappen van rijping tot naïeve rijpe B-cellen.
- B-celreceptoren (BCR’s) zijn membraangebonden monomere vormen van IgD en IgM die specifieke antigeen-epitopen binden met hun Fab-antigeenbindende regio’s. Diversiteit van de antigeenbindingspecificiteit wordt gecreëerd door genetische herschikking van V-, D- en J-segmenten, vergelijkbaar met het mechanisme dat voor TCR-diversiteit wordt gebruikt.
- Proteïneantigenen worden T-afhankelijke antigenen genoemd omdat zij B-cellen alleen kunnen activeren met de medewerking van helper-T-cellen. Andere moleculeklassen vereisen geen T-celsamenwerking en worden T-onafhankelijke antigenen genoemd.
- Bij T-celonafhankelijke activering van B-cellen is er sprake van cross-linkage van BCR’s door repetitieve niet-eiwitantigeen-epitopen. Het wordt gekenmerkt door de productie van IgM door plasmacellen en produceert geen geheugen B-cellen.
- T-cel-afhankelijke activering van B-cellen omvat verwerking en presentatie van eiwitantigenen aan helper T-cellen, activering van de B-cellen door cytokines afgescheiden door geactiveerde TH2-cellen, en plasmacellen die verschillende klassen van antilichamen produceren als gevolg van klasse-switching. Ook worden geheugen-B-cellen geproduceerd.
- Tweede blootstelling aan T-afhankelijke antigenen resulteert in een secundaire antilichaamrespons die door geheugen-B-cellen wordt geïnitieerd. De secundaire respons ontwikkelt zich sneller en produceert hogere en duurzamere niveaus van antilichaam met hogere affiniteit voor het specifieke antigeen.
Meerkeuze
Welke van de volgende zou een T-afhankelijk antigeen zijn?
- lipopolysaccharide
- glycolipid
- protein
- carbohydrate
Which of the following would be a BCR?
- CD4
- MHC II
- MHC I
- IgD
Which of the following does not occur during the lag period of the primary antibody response?
- activation of helper T cells
- class switching to IgG
- presentation of antigen with MHC II
- binding of antigen to BCRs
Fill in the Blank
________ antigens can stimulate B cells to become activated but require cytokine assistance delivered by helper T cells.
T-independent antigens can stimulate B cells to become activated and secrete antibodies without assistance from helper T cells. These antigens possess ________ antigenic epitopes that cross-link BCRs.
Think about It
A patient lacks the ability to make functioning T cells because of a genetic disorder. Would this patient’s B cells be able to produce antibodies in response to an infection? Explain your answer.