


Inhoudsopgave
Pathofysiologie van PCOS
Diagnostische criteria
Insulineresistentie en Leptineresistentie
Auteurs
Velen van ons realiseren zich niet hoe goed het ingewikkelde systeem van feedback loops in ons reproductieve endocriene systeem werkt, totdat ze op een of andere manier worden verstoord. Polycysteus ovarium syndroom (PCOS) is hier een voorbeeld van. Het is een aandoening die wordt gekenmerkt door een verzameling symptomen, en komt veel voor bij patiënten die zich in onvruchtbaarheidsklinieken melden, en treft 5-10% van de vrouwen in de vruchtbare leeftijd. Naar schatting 90% van de anovulatoire gevallen houdt verband met PCOS. Naast een negatieve invloed op de stofwisselingsparameters en de ovulatie, wordt het ook in verband gebracht met verschillende psychische problemen (zoals depressie en angst) bij de vrouwen die het hebben. In deel 1 bespreken we de pathofysiologie van PCOS, de diagnostische criteria, en insuline- en leptineresistentie. In deel 2 gaan we in op de behandeling van PCOS, de psychologische implicaties en de unieke rol van de clinicus in de ondersteuning van de patiënt met PCOS.
Pathofysiologie van PCOS
Bij ovulatoire vrouwen, onder invloed van een goed functionerende hypothalamus-hypofyse-ovarium (HPO) as, wordt de menstruatiecyclus gekenmerkt door de groei en ontwikkeling van (meestal) een enkele follikel die uit het cohort (groep follikels) van die maand wordt gehaald. Als reactie op GnRH-stimulatie scheidt de voorste hypofyse twee belangrijke gonadotrofinen af: Follikel Stimulerend Hormoon (FSH) en Luteïniserend Hormoon (LH). FSH werkt in op de eierstok om kleine follikels te helpen groeien en rijpen. De dominante follikel van die maand is de follikel die de meeste FSH-receptoren heeft verworven. Deze follikel zal blijven groeien en rijpen ten koste van de overige kleine follikels, die dan door het lichaam worden geabsorbeerd (maar nog steeds worden afgetrokken van de totale eicelvoorraad van de vrouw). De groei van de dominante follikel genereert de productie van oestradiol en verhoogde oestrogeenniveaus signaleren dat de productie van FSH stopt via een negatief terugkoppelingssysteem, maar een hoog en aanhoudend oestrogeenniveau zal een eenmalige LH-piek teweegbrengen die de eisprong veroorzaakt.
Bij een vrouw met PCOS functioneert de HPO-as niet normaal. Het pulserende hormoon GnRH is veranderd, wat resulteert in een verhoogde LH-activiteit door de hypofyse. Deze verhoging van het LH verhoogt de stimulatie van de theca-cellen (zie fig. 1), die androsteendion en testosteron produceren, twee androgenen, en het resulterende hyperandrogene milieu van de eierstok verhindert een normale follikelgroei, rijping en ovulatie. De eierstok wordt dan opgebouwd uit vele kleine, antrale follikels die nooit dominant worden. De verzameling van deze follikels kan leiden tot een toename van de grootte van de eierstokken en een licht verhoogd basaal serum oestrogeenniveau genereren. Het blijft onbekend waarom PCOS voorkomt en wie het treft, maar men denkt dat genetica en omgevingsfactoren een complexe wisselwerking hebben bij het ontstaan en de klinische manifestaties.
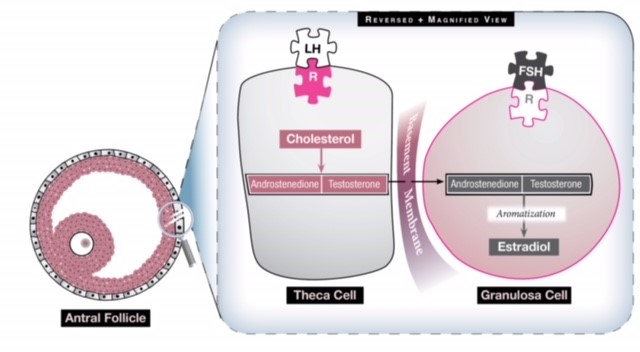
Fig 1: Er zijn twee cellen in de eierstok die bijdragen aan de oestrogeenproductie en ze werken synergetisch. De theca cel zet cholesterol om in twee androgenen (androsteendion en testosteron) onder invloed van LH. Deze androgenen gaan vervolgens via het basaalmembraan naar de granulosacel die ze onder invloed van FSH omzet in oestrogeen via een proces dat aromatisering wordt genoemd. Overmatige LH-stimulatie genereert dus meer androgenen dan kunnen worden omgezet in oestrogeen, zodat het oestrogeenniveau nooit hoog genoeg wordt om een LH-opstoot te veroorzaken en de eierstok een hyperandrogeen milieu heeft.
Diagnostische criteria
PCOS wordt niet gedefinieerd of gediagnosticeerd aan de hand van één simpel symptoom en is vaak een uitsluitingsdiagnose voor vrouwen met oligo-ovulatie en aanwijzingen voor hyperandrogenisme (zoals acne-alopecia en hirsutisme (haargroei en haartextuur met een mannelijk patroon) zodra andere aandoeningen zijn uitgesloten. Het treft vrouwen van alle vormen, maten en achtergronden. Hoewel de symptomen al bij de menarche kunnen beginnen, aarzelen de meeste artsen om een relatief jong menstruerende adolescent met PCOS te diagnosticeren, omdat onregelmatige menstruatie in het eerste jaar na de menarche normaal is en na verloop van tijd kan verdwijnen. De diagnostische criteria die tegenwoordig het meest worden gebruikt, werden in 2003 herzien tijdens een internationale workshop van deskundigen in Rotterdam, Nederland, en worden de “Rotterdam criteria” genoemd, waarbij het volgende werd vastgesteld: PCOS kan alleen worden gediagnosticeerd wanneer een patiënte ten minste twee van de drie volgende kenmerken heeft: oligo/anovulatie, hyperandrogenisme (biochemisch of klinisch), en de aanwezigheid van polycysteuze eierstokken op echografie.Hyperandrogenisme wordt ofwel klinisch gediagnosticeerd (door de clinicus die androgene symptomen waarneemt) of biochemisch (zoals verhoogde serum vrije testosteronspiegels).
Deze criteria zijn in 2018 herzien door een internationale commissie die een paar wijzigingen heeft aangebracht. Ten eerste, vanwege de beschikbaarheid van gevoelige transvaginale echografiemachines, wordt polycysteuze ovariummorfologie (PCOM) gekenmerkt door de aanwezigheid van 20 of meer follikels (<10 mm) in een van beide eierstokken of een ovariumvolume ≥ 10 mlon een van beide eierstokken zoals gezien door transvaginale echografie, vaak gelegen rond deperiferie van de eierstok (of eierstokken). De richtlijnen van 2018 stellen ook dat als een vrouw onregelmatige menstruatiecycli en hyperandrogenisme heeft, de echografie niet nodig is voor de diagnose, hoewel veel clinici er nog steeds de voorkeur aan geven om deze uit te voeren. Anti-Mullerian Hormone (AMH) niveaus zijn vaak verhoogd bij PCOS-patiënten, hoewel dit niet specifiek is voor PCOS omdat verhoogde niveaus kunnen worden gevonden bij vrouwen zonder de aandoening. Bij vrouwen met PCOS wijst een verhoogde AMH-spiegel op een hoger aantal follikels die in de pre-antrale en antrale stadia zijn gearresteerd en niet tot ovulatie komen.
Andere aandoeningen die onregelmatige menstruatiecycli veroorzaken (zwangerschap, hypo- en hyperthyreoïdie, eierstokfalen en hyperprolactinemie) en hyperandrogenisme (congenitale bijnierhyperplasie, bijniertumor en androgeenproducerende tumor) moeten eerst worden uitgesloten, Daarom worden naast serum bHCG ook basaal FSH en LH, schildklierstimulerend hormoon (TSH), prolactine, totaal en vrij testosteron, 17-hydroxyprogesteron (17OHP), dehydroepiandrosteron sulfaat (DHEAS) afgenomen. Een van de moeilijkste differentiële diagnoses is het onderscheiden van een vrouw met functionele hypothalamus amenorroe (FHA) en een magere vrouw met PCOS. Klassiek hebben vrouwen met FHA een laag BMI, maar het kan ook in het lage/normale bereik zijn. Beide aandoeningen worden gekenmerkt door anovulatie en eierstokken die veel kleine follikels lijken te hebben in rusttoestand. Hoewel hyperandrogenisme geen onderdeel is van FHA, kunnen vrouwen met deze aandoening hirsutisme hebben als gevolg van hun etniciteit, waardoor het klinische beeld nog verwarrender wordt. Een manier om FHA vanPCOS te onderscheiden is met bloedonderzoek en echografisch onderzoek. Vrouwen met FHA hebben vaak lage tot normale basale FSH- en LH-spiegels (door hypo-stimulatie van de eierstokken) en een laag oestrogeenniveau, terwijl vrouwen met PCOS meestal verhoogde serum LH-spiegels hebben en lage tot normale FSH-spiegels. Bij een echografie zijn de baarmoeder en de eierstokken van vrouwen met FHA klein of klein/normaal, terwijl vrouwen met PCOS doorgaans een groter ovarieel volume hebben (>10 ml).Er is onderzoek in opkomst naar een mogelijk verband tussen zowel FHA als PCOS, aangezien niet alle vrouwen karakteristieke kenmerken van beide aandoeningen vertonen en FHA en PCOS wel enkele overlappende kenmerken hebben.
Insulineresistentie en leptineresistentie
Hoewel de diagnose insulineresistentie (IR) geen deel uitmaakt van de Rotterdam Criteria, komt het wel veel voor bij vrouwen met PCOS. Een verhoogde BMI verhoogt de kans dat een vrouw met PCOS IR heeft, maar zelfs vrouwen zonder obesitas met PCOS hebben veel meer kans om insulineresistentie te ontwikkelen dan hun vergelijkbare vrouwen zonder PCOS. Naast de gevolgen van IR voor de gezondheid (zoals het metabool syndroom en diabetes mellitus type 2), verergert het ook en draagt het bij tot hyperandrogenisme in een patiëntenpopulatie die daar al aan lijdt.
De gouden standaard voor het diagnosticeren van insulineresistentie is het gebruik van een hyperinsulinemische euglykemische clamp, een test die moet worden uitgevoerd in een ziekenhuisomgeving. Voor de meesten is dit onredelijk, dus wordt er indirect op IR getest. Bij vrouwen met PCOS in een klinische preconceptionele setting wordt voorgesteld een orale glucosetolerantietest (OGTT) uit te voeren, gezien het hoge risico van vrouwen met PCOS om tijdens de zwangerschap een verminderde glucosetolerantie en zwangerschapsdiabetes te ontwikkelen. Hoewel deze test enige tijd in beslag neemt, verdient hij de voorkeur boven nuchtere plasmaglucose- en insulineniveaus alleen, omdat hiermee in een vroeger stadium een verminderde glucosetolerantie kan worden gediagnosticeerd.Bij vrouwen met PCOS die niet tot een hoogrisicocategorie behoren (d.w.z, BMI<25 kg/m2 , geen zwangerschapswens, geen persoonlijke of familieanamnese van verminderde glucosetolerantie) kan het nuttig zijn om ten minste een baseline nuchtere glucose-, insuline- en hemoglobinA1c-spiegel te verkrijgen om een ‘momentopname’ van de glycemische status van de patiënte te krijgen.
Wanneer een vrouw PCOS heeft, versterkt overgewicht of obesitas de metabole gevolgen. Witte vetcellen zijn metabolisch actief. Op een normaal niveau zijn ze beschermend, omdat ze een veilig onderkomen voor lipiden bieden en vet uit de organen houden. Wanneer er te veel vetcellen zijn, kunnen ze overbelast raken en barsten, waarbij vetzuren vrijkomen in de bloedbaan die elk orgaan kunnen aantasten. Deze vetcellen komen ‘vast te zitten’ tussen de cellen in organen en veroorzaken dat deze stijf, beschadigd en minder functioneel worden en chronische ontstekingen veroorzaken. Het is niet ongewoon om de diagnose “leververvetting” te stellen bij een vrouw met PCOS die zwaarlijvig is, omdat de lever bijzonder kwetsbaar is. Bovendien kan een teveel aan adipositas de bestaande hyperinsulinemie en insulineresistentie bestendigen door het verstoren van het delicate evenwicht van cytokinen en hormonen die door vetweefsel worden geproduceerd (zie figuur 2), bijvoorbeeld door het verminderen van de productie van cytokinen die de insulinegevoeligheid verhogen en het verhogen van cytokinen die ontsteking en insulineresistentie bevorderen. Een teveel aan insuline draagt verder bij tot abdominale adipositas en hyperandrogenisme, waardoor bij PCOS-patiënten een vicieuze cirkel ontstaat die moeilijk te doorbreken kan zijn.
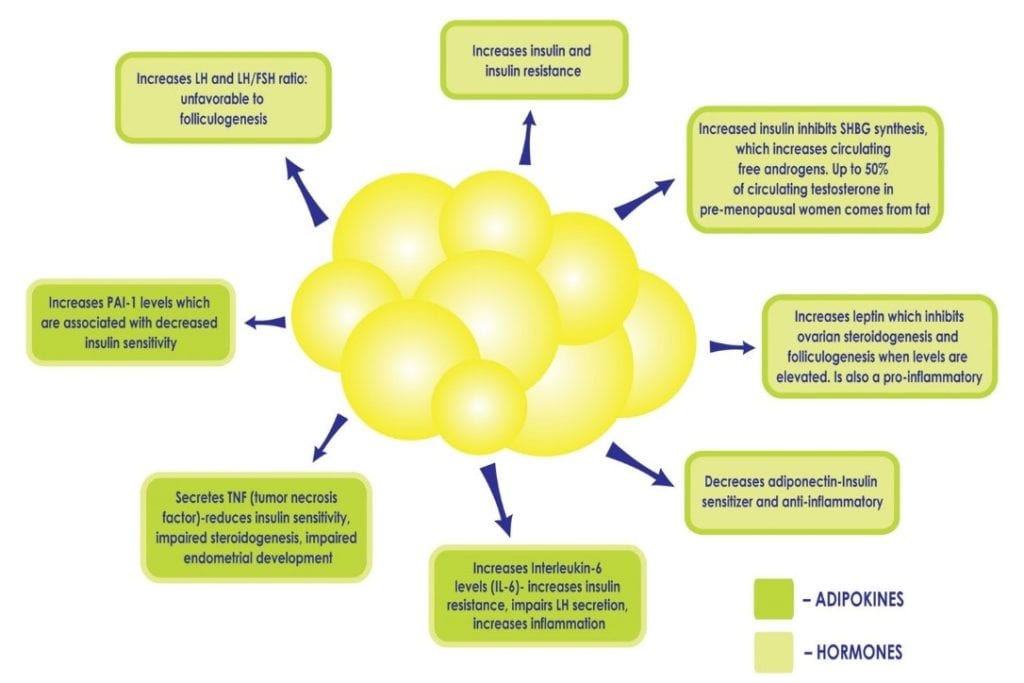
Figuur 2: Verhoogde adipositas, en de daaropvolgende toename van vetcellen, kan hyperinsulinemie en insulineresistentie bestendigen door het verstoren van de delicate balans van hormonen die door vetweefsel worden geproduceerd, zoals het verlagen van de productie van adiponectine, een cytokine dat de insulinegevoeligheid verhoogt, en het verhogen van andere die ontstekingen bevorderen.
Naast insulineresistentie kunnen patiënten met PCOS en obesitas ook lijden aan wat sommigen leptineresistentie noemen. Sommige studies hebben aangetoond dat de leptinespiegel hoger is bij zwaarlijvige PCOS-patiënten in vergelijking met magere patiënten. Leptine is een eiwit dat door vetweefsel wordt geproduceerd en dat de energiebalans en de eetlust van het lichaam regelt. Als het goed werkt, geeft een toename van leptine de hersenen het signaal om de eetlust te verminderen en een afname van leptine doet het tegenovergestelde, het geeft de hersenen het signaal om de eetlust te vergroten om de brandstof te leveren die nodig is voor energie. Bij veel PCOS-patiënten met obesitas is dit systeem echter defect en, ondanks verhoogde leptineconcentraties als gevolg van de toename van vetweefsel, neemt de werkzaamheid van leptine af, wat leidt tot leptineresistentie. Leptineresistentie wordt beschouwd als een belangrijke risicofactor voor de pathogenese van overgewicht en obesitas, aangezien het lichaam ongevoelig blijft voor verhoogde niveaus en de vrouw signalen geeft dat zij nog steeds honger heeft/niet verzadigd is, zelfs na het eten. Veel vrouwen met PCOS klagen over “nooit een vol gevoel” als gevolg van deze weerstand en blijven eten, wat leidt tot een toename van het vetweefsel, wat resulteert in een verhoogde leptineresistentie en deze schadelijke cyclus bestendigt. Als gevolg hiervan komen overgewicht en obesitas veel voor bij vrouwen met PCOS en kan gewichtsverlies onmogelijk lijken, omdat intuïtief eten niet effectief is wanneer honger- en verzadigingsgevoelens onbetrouwbaar zijn.
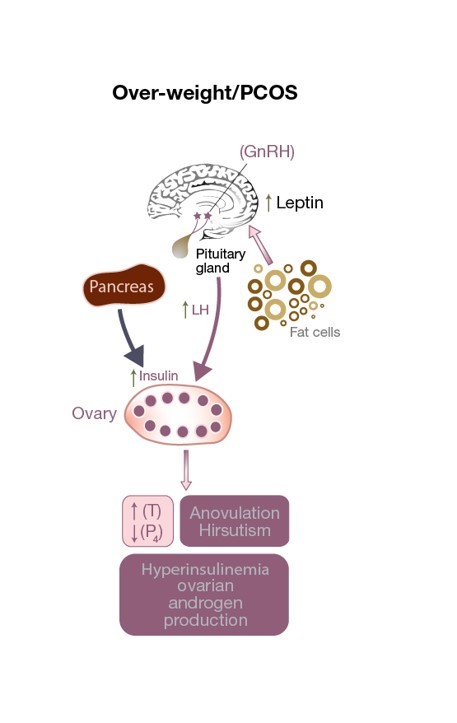
Figuur 3: Verstoring van de HPO-as bij een PCOS-patiënt. Er is een overmatige LH-stimulatie op de theca-cel, wat resulteert in een verhoging van de testosteronspiegel, een androgene omgeving van de eierstokken en anovulatie (wat resulteert in lage progesteronspiegels). Verhoogde leptinespiegels als gevolg van een overmaat aan vetcellen beïnvloeden de GnRH-secretie. Verhoogde insulinespiegels dragen bij tot hyperandrogenisme.
Een verminderde leptineafscheiding heeft niet alleen gevolgen voor het lichaamsgewicht, maar kan ook een nadelig effect hebben op de ovulatie (zie fig. 3) en zelfs op de bevruchting bij PCOS-patiënten met een normaal gewicht. Het verandert de afgifte van GnRH door de hypothalamus, waardoor de stimulatie door de voorste hypofyse (en daardoor de secretie van FSH en LH) afneemt en de ontwikkeling van een rijpe eicel wordt verhinderd. Bovendien slaan de granulosacellen ook leptine op en produceren ze ook leptine, en hoge leptineniveaus verminderen hun aromatiseringscapaciteit, waardoor uiteindelijk het vermogen van een dominante follikel om voldoende hoeveelheden oestrogeen te produceren wordt belemmerd (zie fig. 1). Een kleine observationele studie vond een direct verband tussen de concentratie van leptine in het follikelvocht (FF-leptine) (dat gecorreleerd is met het bevruchtingspercentage) bij magere vrouwen met PCOS die IVF hebben ondergaan, in vergelijking met normaal ovulerende vrouwen met een gelijk gewicht.
Auteurs
Jaclyn Carr, BSN
Brianna Giannotte, BSN
Monica Moore, MSN, RNC
Speciale dank aan NeilChappell, MD voor zijn hulp bij het redigeren van dit artikel.
You can visit the FertilityNurse Newsletter website here
Want to be notified about upcoming Fertility Newsletter posts here at The ObG Project?
Get the ObG Insider e-Newsletter ”



![]()