


Inhaltsverzeichnis
Pathophysiologie des PCOS
Diagnosekriterien
Insulinresistenz und Leptinresistenz
Autoren
Viele von uns sind sich nicht bewusst, wie gut das komplizierte System von Rückkopplungsschleifen in unserem reproduktiven Hormonsystem funktioniert, bis es in irgendeiner Weise gestört wird. Das polyzystische Ovarialsyndrom (PCOS) ist ein Beispiel dafür. Es handelt sich dabei um eine Erkrankung, die durch eine Reihe von Symptomen gekennzeichnet ist. 5-10 % der Frauen im fortpflanzungsfähigen Alter stellen sich in einer Klinik für Unfruchtbarkeit vor. Schätzungsweise 90 % der anovulatorischen Fälle sind auf PCOS zurückzuführen. PCOS wirkt sich nicht nur negativ auf die Stoffwechselparameter und den Eisprung aus, sondern wird auch mit verschiedenen psychischen Problemen (wie Depressionen und Angstzuständen) bei den betroffenen Frauen in Verbindung gebracht. In Teil 1 werden wir die Pathophysiologie des PCOS, seine Diagnosekriterien sowie die Insulin- und Leptinresistenz erörtern. In Teil 2 befassen wir uns mit der Behandlung von PCOS, den psychologischen Auswirkungen und der besonderen Rolle des Arztes bei der Unterstützung von Patientinnen mit PCOS.
Pathophysiologie des PCOS
Bei ovulatorischen Frauen ist der Menstruationszyklus unter dem Einfluss einer gut funktionierenden Hypothalamus-Hypophysen-Eierstock-Achse (HPO) durch das Wachstum und die Entwicklung eines einzelnen Follikels (normalerweise) gekennzeichnet, der aus der Kohorte (Gruppe von Follikeln) des jeweiligen Monats entnommen wird. Als Reaktion auf die GnRH-Stimulation schüttet der Hypophysenvorderlappen zwei wichtige Gonadotropine aus: Follikelstimulierendes Hormon (FSH) und Luteinisierendes Hormon (LH). FSH wirkt auf den Eierstock, um das Wachstum und die Reifung kleiner Follikel zu fördern. Der dominante Follikel in diesem Monat ist derjenige, der die meisten FSH-Rezeptoren erworben hat. Dieser Follikel wächst und reift weiter auf Kosten der übrigen kleinen Follikel, die dann vom Körper resorbiert werden (aber immer noch vom gesamten Eizellenvorrat der Frau abgezogen werden). Das Wachstum des dominanten Follikels führt zu einer Östradiolproduktion, und ein erhöhter Östrogenspiegel signalisiert über ein negatives Rückkopplungssystem, dass die FSH-Produktion eingestellt wird; ein hoher und anhaltender Östrogenspiegel löst jedoch einen einmaligen LH-Schub aus, der den Eisprung auslöst.
Bei einer Frau mit PCOS ist die HPO-Achse nicht normal funktionsfähig. Das pulsierende Hormon GnRH ist verändert, was zu einer erhöhten LH-Aktivität in der Hypophyse führt. Dieser LH-Anstieg steigert die Stimulation der Thekazellen (siehe Abb. 1), die die beiden Androgene Androstendion und Testosteron produzieren, und das daraus resultierende hyperandrogene Milieu des Eierstocks verhindert das normale Follikelwachstum, die Reifung und den Eisprung. Der Eierstock besteht dann aus vielen kleinen, antralen Follikeln, die nie dominant werden. Die Ansammlung dieser Follikel kann zu einer Vergrößerung der Eierstöcke führen und einen leicht erhöhten Östrogenspiegel im Basalserum erzeugen. Es ist nach wie vor unbekannt, warum PCOS auftritt und wen es betrifft, aber man nimmt an, dass Genetik und Umweltfaktoren ein komplexes Zusammenspiel bei der Entstehung und den klinischen Manifestationen haben.
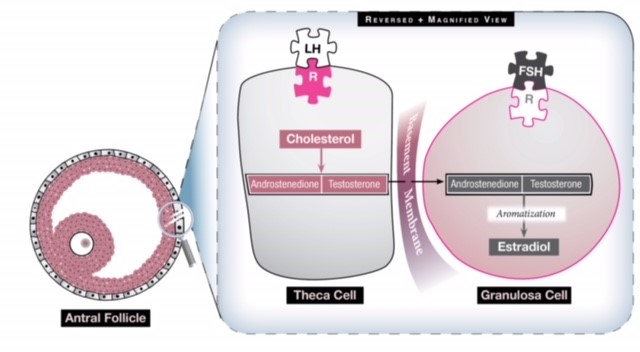
Abbildung 1: Im Eierstock gibt es zwei Zellen, die zur Östrogenproduktion beitragen und synergetisch wirken. Die Thekazelle wandelt unter dem Einfluss von LH Cholesterin in zwei Androgene (Androstendion und Testosteron) um. Diese Androgene wandern dann durch die Basalmembran in die Granulosazelle, die sie unter dem Einfluss von FSH über einen als Aromatisierung bezeichneten Prozess in Östrogen umwandelt. Bei einer übermäßigen LH-Stimulation werden also mehr Androgene erzeugt, als in Östrogen umgewandelt werden können, so dass der Östrogenspiegel nie hoch genug wird, um einen LH-Schub zu erzeugen, und das Ovar ein hyperandrogenes Milieu aufweist.
Diagnosekriterien
PCOS wird nicht durch ein einziges Symptom definiert oder diagnostiziert und ist oft eine Ausschlussdiagnose für Frauen, die eine Oligo-Ovulation und Anzeichen von Hyperandrogenismus (wie Akne, Alopezie und Hirsutismus (männlich gemusterter Haarwuchs und -struktur) aufweisen, sobald andere Erkrankungen ausgeschlossen sind. Sie betrifft Frauen aller Formen, Größen und Hintergründe. Obwohl die Symptome bereits bei der Menarche auftreten können, zögern die meisten Ärzte, bei einer relativ frisch menstruierenden Jugendlichen ein PCOS zu diagnostizieren, da Zyklusunregelmäßigkeiten im ersten Jahr nach der Menarche normal sind und sich mit der Zeit zurückbilden können. Die heute am häufigsten verwendeten Diagnosekriterien wurden 2003 auf einem internationalen Experten-Workshop in Rotterdam (Niederlande) überarbeitet und als Rotterdam-Kriterien bezeichnet, in denen Folgendes festgelegt wurde PCOS kann nur diagnostiziert werden, wenn eine Patientin mindestens zwei von drei Merkmalen aufweist: Oligo-/Anovulation, Hyperandrogenismus (biochemisch oder klinisch) und das Auftreten von polyzystischen Ovarien im Ultraschall.Hyperandrogenismus wird entweder klinisch (durch den Arzt, derandrogene Symptome beobachtet) oder biochemisch (z. B. erhöhte freie Testosteronwerte im Serum) diagnostiziert.
Diese Kriterien wurden 2018 von einem internationalen Ausschuss überarbeitet, der einige Änderungen vornahm. Erstens wird aufgrund der Verfügbarkeit empfindlicher transvaginaler Ultraschallgeräte die polyzystische Ovarialmorphologie (PCOM) durch das Vorhandensein von 20 oder mehr Follikeln (<10 mm) in einem der beiden Eierstöcke oder ein Ovarialvolumen ≥ 10 ml in einem der beiden Eierstöcke im transvaginalen Ultraschall charakterisiert, die sich häufig in der Peripherie des Ovars (oder der Ovarien) befinden. In den Leitlinien von 2018 heißt es außerdem, dass bei Frauen mit unregelmäßigen Menstruationszyklen und Hyperandrogenismus kein Ultraschall für die Diagnose erforderlich ist, auch wenn viele Kliniker diesen nach wie vor vorziehen. Der Anti-Mullerian-Hormon-Spiegel (AMH) ist bei PCOS-Patientinnen häufig erhöht, obwohl dies nicht spezifisch für PCOS ist, da erhöhte Werte auch bei Frauen ohne diese Erkrankung gefunden werden können. Bei Frauen mit PCOS spiegelt ein erhöhter AMH-Spiegel eine größere Anzahl von Follikeln wider, die in den präantralen und antralen Stadien festsitzen und keinen Eisprung haben.
Andere Erkrankungen, die zu unregelmäßigen Menstruationszyklen führen können (Schwangerschaft, Hypo- und Hyperthyreose, Ovarialinsuffizienz und Hyperprolaktinämie) sowie Hyperandrogenismus (kongenitale Nebennierenhyperplasie, Nebennierentumor und androgensezernierender Tumor) müssen zunächst ausgeschlossen werden, Daher werden zusätzlich zu den bHCG-Serumspiegeln basale FSH- und LH-Spiegel, Schilddrüsenstimulierendes Hormon (TSH), Prolaktin, Gesamt- und freies Testosteron, 17-Hydroxyprogesteron (17OHP) und Dehydroepiandrosteron-Sulfat (DHEAS) bestimmt. Eine der schwierigsten Differentialdiagnosen ist die Unterscheidung zwischen einer Frau mit funktioneller hypothalamischer Amenorrhoe (FHA) und einer schlanken Frau mit PCOS. Klassischerweise haben Frauen mit FHA einen niedrigen BMI, der aber auch im niedrigen/normalen Bereich liegen kann. Beide Erkrankungen sind durch Anovulation und Eierstöcke gekennzeichnet, die im Ruhezustand viele kleine Follikel zu haben scheinen. Obwohl Hyperandrogenismus kein Bestandteil der FHA ist, können Frauen mit dieser Erkrankung aufgrund ihrer ethnischen Zugehörigkeit Hirsutismus haben, was das klinische Bild weiter verwirrt. Eine Möglichkeit, FHA von PCOS zu unterscheiden, sind Bluttests und Ultraschalluntersuchungen. Frauen mit FHA haben häufig niedrige bis normale basale FSH- und LH-Spiegel (aufgrund einer Unterstimulation der Eierstöcke) und einen niedrigen Östrogenspiegel, während Frauen mit PCOSt typischerweise erhöhte LH-Serumspiegel und niedrige bis normale FSH-Spiegel aufweisen. Im Ultraschall sind die Gebärmutter und die Eierstöcke von Frauen mit FHA klein oder klein/normal, während Frauen mit PCOS typischerweise ein vergrößertes Eierstockvolumen haben (>10 ml). Es gibt neue Forschungsergebnisse über einen möglichen Zusammenhang zwischen FHA und PCOS, da nicht alle Frauen die charakteristischen Merkmale beider Erkrankungen aufweisen und FHA und PCOS einige sich überschneidende Merkmale haben.
Insulinresistenz und Leptinresistenz
Obwohl die Diagnose einer Insulinresistenz (IR) nicht zu den Rotterdam-Kriterien gehört, ist sie bei Frauen mit PCOS sehr häufig anzutreffen. Ein erhöhter BMI erhöht die Wahrscheinlichkeit, dass eine Frau mit PCOS an IR leidet, aber auch nicht fettleibige Frauen mit PCOS haben ein weitaus höheres Risiko, eine Insulinresistenz zu entwickeln, als ihre gleich großen Geschlechtsgenossinnen ohne PCOS. Zusätzlich zu den gesundheitlichen Folgen der IR (wie metabolisches Syndrom und Diabetes mellitus Typ 2) verschlimmert sie auch den Hyperandrogenismus in einer Patientenpopulation, die bereits darunter leidet.
Der Goldstandard für die Diagnose der Insulinresistenz ist die Verwendung eines hyperinsulinämischen euglykämischen Clamps, ein Test, der in einem Krankenhaus durchgeführt werden muss. Für die meisten ist dies unzumutbar, so dass ein indirekter Test auf IR durchgeführt wird. Bei Frauen mit PCOS in einem klinischen Umfeld vor der Empfängnis wird empfohlen, einen oralen Glukosetoleranztest (OGTT) durchzuführen, da bei Frauen mit PCOS ein hohes Risiko besteht, während der Schwangerschaft eine gestörte Glukosetoleranz und einen Gestationsdiabetes zu entwickeln. Dieser Test ist zwar etwas zeitaufwendig, wird aber den Nüchternplasmaglukose- und Insulinwerten allein vorgezogen, da er eine gestörte Glukosetoleranz in einem früheren Stadium diagnostizieren kann.Bei Frauen mit PCOS, die nicht in eine Hochrisikokategorie fallen (d. h., BMI<25 kg/m2, kein Kinderwunsch, keine persönliche oder familiäre Anamnese einer gestörten Glukosetoleranz), kann die Bestimmung von Nüchternglukose-, Insulin- und HämoglobinA1c-Werten hilfreich sein, um eine „Momentaufnahme“ des Blutzuckerstatus der Patientin zu erhalten.
Wenn eine Frau an PCOS leidet, verstärkt Übergewicht oder Fettleibigkeit die Folgen für den Stoffwechsel. Die weißen Fettzellen sind stoffwechselaktiv. In normalem Umfang haben sie eine schützende Funktion, da sie ein sicheres Zuhause für Lipide bieten und das Fett von den Organen fernhalten. Wenn es zu viele Fettzellen gibt, können sie überlastet werden und platzen, wodurch Fettsäuren in den Blutkreislauf gelangen, die jedes Organ beeinträchtigen können. Diese Fettzellen bleiben zwischen den Zellen in den Organen „stecken“ und führen dazu, dass diese steif, beschädigt und weniger funktionsfähig werden und chronische Entzündungen verursachen. Bei Frauen mit PCOS, die übergewichtig sind, wird nicht selten eine Fettleber“ diagnostiziert, da die Leber besonders anfällig ist. Darüber hinaus kann eine übermäßige Adipositas eine bestehende Hyperinsulinämie und Insulinresistenz verewigen, indem sie das empfindliche Gleichgewicht der vom Fettgewebe produzierten Zytokine und Hormone stört (siehe Abbildung 2), z. B. indem sie die Produktion von Zytokinen, die die Insulinsensitivität erhöhen, verringert und jene, die Entzündungen und Insulinresistenz fördern, erhöht. Überschüssiges Insulin trägt weiter zu abdominaler Adipositas und Hyperandrogenismus bei, wodurch bei PCOS-Patientinnen ein Teufelskreis entsteht, der nur schwer zu überwinden ist.
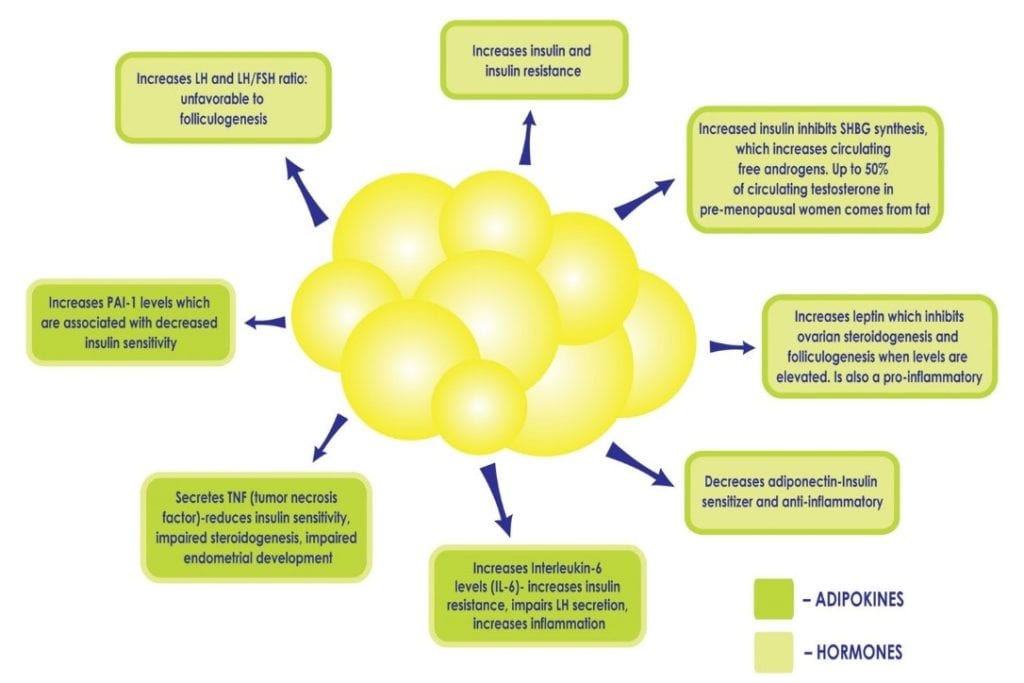
Abbildung 2: Erhöhte Adipositas und die daraus resultierende Vermehrung der Fettzellen können Hyperinsulinämie und Insulinresistenz verewigen, indem sie das empfindliche Gleichgewicht der vom Fettgewebe produzierten Hormone stören, z. B. indem sie die Produktion von Adiponektin, einem Zytokin, das die Insulinempfindlichkeit erhöht, verringern und andere, die Entzündungen fördern, erhöhen.
Neben der Insulinresistenz können Patientinnen mit PCOS und Adipositas auch an einer so genannten Leptinresistenz leiden. Einige Studien haben gezeigt, dass der Leptinspiegel bei fettleibigen PCOS-Patientinnen höher ist als bei schlanken Patientinnen. Leptin ist ein vom Fettgewebe produziertes Protein, das den Energiehaushalt und den Appetit des Körpers reguliert. Wenn es richtig funktioniert, signalisiert ein Anstieg des Leptinspiegels dem Gehirn, den Appetit einer Person zu verringern, und ein Rückgang des Leptinspiegels bewirkt das Gegenteil: Er signalisiert dem Gehirn, den Appetit zu steigern, um den für die Energie benötigten Brennstoff bereitzustellen. Bei vielen PCOS-Patientinnen mit Adipositas ist dieses System jedoch gestört, und trotz erhöhter Leptinkonzentrationen, die auf die Zunahme des Fettgewebes zurückzuführen sind, nimmt die Wirksamkeit von Leptin ab, was zu einer Leptinresistenz führt. Die Leptinresistenz gilt als wichtiger Risikofaktor für die Entstehung von Übergewicht und Adipositas, da der Körper unempfindlich gegenüber erhöhten Spiegeln bleibt und der Frau signalisiert, dass sie auch nach dem Essen noch hungrig/nicht gesättigt ist. Viele Frauen mit PCOS klagen darüber, dass sie sich aufgrund dieser Resistenz „nie satt“ fühlen, und essen weiter, was zu einer Zunahme des Fettgewebes führt, was wiederum eine erhöhte Leptinresistenz zur Folge hat und diesen schädlichen Kreislauf aufrechterhält. Infolgedessen sind Übergewicht und Fettleibigkeit bei Frauen mit PCOS weit verbreitet, und eine Gewichtsabnahme kann sich unmöglich anfühlen, da intuitives Essen nicht effektiv ist, wenn Hunger- und Sättigungsgefühle unzuverlässig sind.
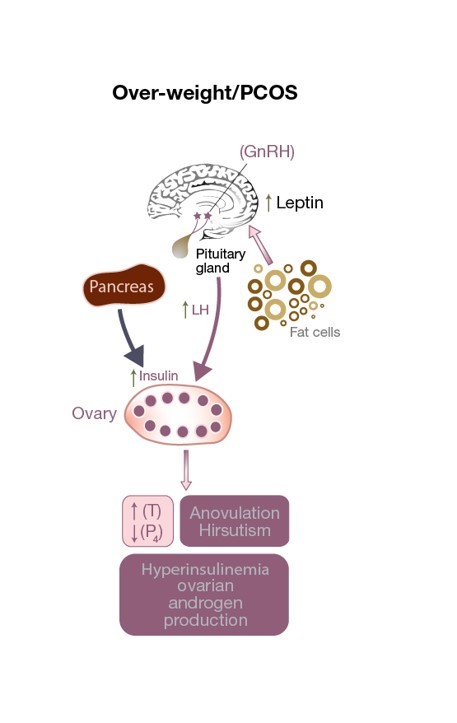
Abbildung 3: Störung der HPO-Achse bei einer PCOS-Patientin. Es kommt zu einer übermäßigen LH-Stimulation der Thekazellen, was zu einem Anstieg des Testosteronspiegels, einer androgenen Umgebung in den Eierstöcken und einer Anovulation (die zu einem niedrigen Progesteronspiegel führt) führt. Erhöhte Leptinspiegel aufgrund eines Überschusses an Fettzellen beeinflussen die GnRH-Sekretion. Erhöhte Insulinspiegel tragen zum Hyperandrogenismus bei.
Eine gestörte Leptinsekretion wirkt sich nicht nur auf das Körpergewicht aus, sondern kann auch den Eisprung (siehe Abb. 3) und sogar die Befruchtung bei normalgewichtigen PCOS-Patienten beeinträchtigen. Es verändert die Freisetzung von GnRH aus dem Hypothalamus, wodurch die Stimulation des Hypophysenvorderlappens (und damit dieFSH- und LH-Sekretion) verringert und die Entwicklung einer reifen Eizelle verhindert wird. Darüber hinaus speichern und produzieren die Granulosazellen auch Leptin, und ein hoher Leptingehalt verringert ihre Aromatisierungskapazität, was letztlich die Fähigkeit eines dominanten Follikels beeinträchtigt, ausreichende Mengen an Östrogen zu produzieren (siehe Abb. 1). In einer kleinen Beobachtungsstudie wurde eine direkte Korrelation zwischen der Leptinkonzentration im Follikelfluid (FF-Leptin) (die mit der Befruchtungsrate korreliert ist) bei schlanken Frauen mit PCOS, die sich einer IVF unterzogen haben, im Vergleich zu normal ovulierenden, gewichtsgleichen Frauen festgestellt.
Autoren
Jaclyn Carr, BSN
Brianna Giannotte, BSN
Monica Moore, MSN, RNC
Besonderer Dank geht an NeilChappell, MD für seine Unterstützung bei der Bearbeitung dieses Artikels.
You can visit the FertilityNurse Newsletter website here
Want to be notified about upcoming Fertility Newsletter posts here at The ObG Project?
Get the ObG Insider e-Newsletter “



![]()