1. Przegląd sygnalizacji Erk
Scieżka kinazy regulowanej sygnałem zewnątrzkomórkowym (ERK) jest jedną z głównych kaset sygnalizacyjnych ścieżki sygnalizacji kinazy białkowej aktywowanej mitogenami (MAPK). Kaskada ERK jest aktywowana przez różne czynniki zewnątrzkomórkowe, w tym czynniki wzrostu, hormony, a także stres komórkowy w celu wywołania procesów komórkowych, które obejmują głównie proliferację i różnicowanie, ale w niektórych warunkach również odpowiedź na stres i inne. Głównymi składnikami kinazy MAPK/ERK (MEKK) są członkowie rodziny Raf: Raf-1, A-Raf i B-Raf, które fosforylują dwie reszty serynowe na składnikach kinazy MAPK/ERK (MEK) MEK1/2. ERK1/2 są odpowiedzialne za stymulację efektorów downstream, z których wiele to czynniki transkrypcyjne. Jednym z głównych czynników transkrypcyjnych jest białko CREB (ang. cyclic AMP response element-binding protein).
Ten szlak ERK przyczynia się do kontroli wielu procesów komórkowych:
– Regulacja proliferacji komórek, takich jak aktywacja komórek T
– Plastyczność synaptyczna, taka jak długookresowe potencjowanie (LTP).długotrwała potencjacja (LTP) w neuronach hipokampa
– Proliferacja komórek śródbłonka podczas angiogenezy
– Fosforylacja czynnika transkrypcyjnego p53
– Przebudowa szlaku sygnalizacyjnego ERK może przyczyniać się do rozwoju wielotorbielowatości nerek
– Aktywacja fosfolipazy A2 (PLA2) w komórkach tucznych.
2. Kaskada sygnalizacyjna Erk
Aktywacja kaskady ERK1/2 jest najczęściej inicjowana przez receptory błonowe, takie jak receptorowe kinazy Tyr (RTKs), receptory sprzężone z białkami G (GPCRs), kanały jonowe i inne. Receptory te przekazują sygnał poprzez rekrutację białek adaptorowych (np. Grb2) i czynników wymiany (np. SOS), które z kolei indukują aktywację Ras na błonach plazmatycznych lub błonach innych organelli. Aktywowany, związany z GTP Ras przekazuje następnie sygnał poprzez aktywację kinaz białkowych Raf-1, B-Raf i A-Raf (Rafs) na poziomie MAP3K tej kaskady. Aktywacja ta następuje poprzez rekrutację Rafs do błon, gdzie są one fosforylowane i aktywowane. MOS jest kolejnym MAP3K kaskady ERK, ale działa głównie w układzie rozrodczym poprzez odmienny sposób regulacji. Z poziomu MAP3K sygnał jest następnie przekazywany w dół kaskady poprzez komponenty MAPKK: MEK1/2. Są one aktywowane poprzez fosforylację seryny w typowym dla MAPKK motywie Ser-Xaa-Ala-Xaa-Ser/Thr w ich pętli aktywacyjnej. Z kolei MEK1/2 aktywują swoje jedyne znane substraty, natywne ERK1/2, które funkcjonują jako ich jedyne cele downstream, co sugeruje, że MEK1/2 służą jako komponenty determinujące specyficzność kaskady ERK1/2. MEK1/2 są jedynymi kinazami białkowymi o podwójnej specyficzności, które mogą fosforylować zarówno regulatorowe reszty Thr, jak i Tyr ERK1/2. Do tej pory zidentyfikowano około 200 różnych substratów ERK1/2. Są to substraty albo w cytozolu (np. PLA2 RSK), albo po translokacji, w jądrze, w tym czynniki transkrypcyjne, takie jak Elk1, c-Fos i c-Jun.
– MAP3K-Raf 1
Raf-1 jest najlepiej poznaną cząsteczką sygnalizacji czynników wzrostu na poziomie MAP3K kaskady. Jest to białkowa kinaza serynowo-treoninowa o masie 70-75 kDa, która zawiera domenę kinazową w COOH-końcowej połowie cząsteczki i domenę regulatorową zajmującą pozostałą część. Po stymulacji różnymi mitogenami, Raf-1 ulega przejściowej aktywacji w ciągu 2-3 mm. Mechanizm aktywacji Raf-1 był intensywnie badany przez ostatnie kilka lat. Obecnie wiadomo, że Raf-1 jest zlokalizowana w dół łańcucha od HAS, który wydaje się oddziaływać bezpośrednio z NH2-końcową częścią Raf-1 podczas stymulacji.
– MAPKK-MEK1/2
MEK stanowią ewolucyjnie konserwowaną rodzinę białkowych kinaz serynowo-treoninowych, która do tej pory obejmuje trzy wysoce homologiczne (85%) izoformy u ssaków. Mechanizm aktywacji MEK-1 polega na fosforylacji białka tylko na resztach serynowych i wydaje się być podobny do fosforylacji przez MEKK, Raf-1 lub w wyniku autofosforylacji, jak wynika z map fosfopeptydowych. MAPKK (MEK) są wysoce specyficzne dla komponentów downstream ERK-1 i ERK-2. Ponadto, MAPKK nie rozpoznaje ani zdenaturowanej formy substratu, ani peptydów zawierających miejsca fosforylacji w ERK, co wskazuje, że enzym wymaga natywnej formy MAPK.
– MAPK-ERK-1/2
Z powodu wysokiego stopnia podobieństwa, ERK-1 i ERK-2 są zwykle uważane za funkcjonalnie redundantne. Głównym mechanizmem upstreamowym prowadzącym do fosforylacji ERK-1 i -2 na obu tych resztach regulatorowych jest ich fosforylacja przez MEK. Ze względu na dość szeroki charakter rozpoznawania substratów, ERK mogą fosforylować dużą liczbę białek po ich aktywacji. Białka te mają często charakter regulatorowy i są zlokalizowane zarówno w cytoplazmie, jak i w jądrze komórkowym.
3. Downstream signaling of Erk pathway
– Cell Proliferation
Activated ERK1/2 phosphorylates RSK and both RSK and ERK translocate to the nucleus where they activates multiple transcription factors such as CREB, Fos and Elk-1, ultimately resulting in effector protein synthesis and causing changes in cell proliferation and survival. CREB (cAMP response element-binding protein) jest komórkowym czynnikiem transkrypcyjnym, który może zwiększyć transkrypcję genów ponad 10-krotnie. c-fos jest 380 aminokwasowym białkiem z podstawowym regionem leucynowego suwaka do dimeryzacji i wiązania DNA oraz domeną transaktywacyjną na C-końcu. Jest ono zaangażowane w ważne wydarzenia komórkowe, w tym proliferację, różnicowanie i przeżycie komórek; białko zawierające domenę ETS (Elk-1) jest białkiem, które u ludzi jest kodowane przez gen ELK1. Elk-1 funkcjonuje również jako aktywator transkrypcji.
– Onkogeneza
Aktywacja ERK1/2 promuje metaplazję i rozwój guza poprzez fosforylację Bim i Bid, powodując degradację Bim przez proteasom oraz sekwestrację Bad do białek wiążących fosfoseryny, a tym samym hamując apoptozę. W osobnym szlaku aktywacja ERK1/2 fosforyluje FOXO3a przy Ser 294, Ser 344 i Ser 425 i ułatwia interakcję FOXO3a-MDM2. Interakcja ta nasila degradację FOXO3a poprzez zależny od MDM2 szlak ubikwityna-proteasom, prowadząc do rozwoju nowotworu.
– Rozwój i różnicowanie
Sygnały pochodzące od receptorowych kinaz tyrozynowych, które aktywują szlak kinaz Ras/Raf/MAP, regulują rozwój i różnicowanie wielu typów komórek. Głównie poprzez aktywację transduktorów sygnału i aktywatorów białek transkrypcyjnych (STATs).
– Cykl komórkowy
Cdc25 aktywuje kinazy zależne od cyklin poprzez usuwanie fosforanów z reszt w miejscu aktywnym Cdk. Wiadomo, że kontroluje przejścia z fazy G1 do S oraz z fazy G2 do M. Erk1/2 może aktywować białko Cdc25 i z kolei promować progresję cyklu komórkowego.
4. Regulacja sygnalizacji Erk
Regulacja sygnalizacji Erk jest bardzo ważna dla nas, aby utrzymać normalną funkcję komórek. Istnieje wiele strategii regulacyjnych dla komórki, aby regulować szlak sygnałowy Erk, głównie obejmują regulację przez pętle sprzężenia zwrotnego, przez rusztowania w górę i w dół strumienia, przez fosfatazy i inhibitory szlaku sygnałowego Erk.
– Regulacja pętli sprzężenia zwrotnego
Istnieje kilka punktów ujemnego sprzężenia zwrotnego w szlaku ERK (rysunek 1). MEK jest jednym z celów i może być hamowany przez fosforylację MEK1/2 przez ERK przy Thr292 i Thr212. Fosforylacja zapobiega dalszemu zwiększaniu aktywności MEK przez PAK1, a tym samym zmniejsza aktywację ERK. Fosforylacja Raf w wielu miejscach przez ERK stanowi drugi możliwy mechanizm pętli sprzężenia zwrotnego. Hiperfosforylacja tych miejsc zapobiega interakcji Raf z GTPazą Ras i promuje jej deposforylację przez fosfatazę PP2A. Alternatywnym mechanizmem ujemnego sprzężenia zwrotnego jest aktywacja lub transkrypcyjna regulacja fosfataz przez ERK. Te różne pętle ujemnego sprzężenia zwrotnego aktywowane przez ERK zapewniają jeden ze sposobów ograniczania czasu trwania sygnału i powrotu szlaku do stanu podstawowego.
– Regulacja rusztowań w górę i w dół strumienia
Białka rusztowania wiążą dwa lub więcej komponentów szlaku sygnalizacyjnego, aby zbliżyć je do siebie i w ten sposób ułatwić ich funkcjonalną interakcję. Ponadto, rusztowania mogą kierować te wieloenzymatyczne moduły sygnalizacyjne do różnych lokalizacji komórkowych i w ten sposób wzmacniać fosforylację specyficznego podzbioru substratów down-stream. Rusztowania wpływają również na czas trwania sygnału, zapobiegają przesłuchom między podobnymi szlakami i mogą łączyć aktywację modułu sygnalizacyjnego ze specyficznym sygnałem aktywującym z góry.
– Fosfatazy i inhibitory
Aktywność szlaków MAPK jest określana przez konkurencyjne działania kinaz z góry i hamujących fosfataz. Szlaki MAPK są kończone przez dephosphorylation ich składników przez kilka fosfataz. Wykazano, że kilka fosfataz serynowo-treoninowych, takich jak PP2A i PP2Ca, oraz fosfataz tyrozynowych, takich jak PTP-SL i HePTP, inaktywuje MAPK.
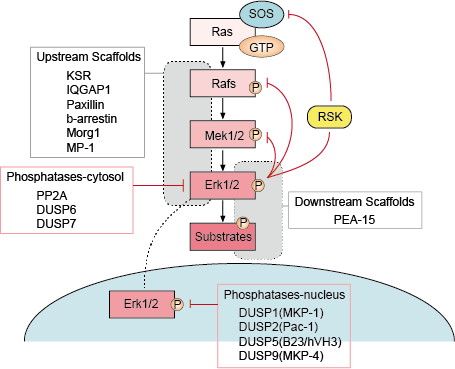
Figura 1. Regulacja szlaku sygnałowego Erk
5. Związek z chorobami
Zgodnie z ich krytycznymi rolami w kluczowych czynnościach komórkowych, w tym proliferacji komórek, różnicowaniu i przeżyciu lub śmierci, szlaki sygnalizacyjne MAPK zostały włączone w patogenezę wielu chorób człowieka.
– Choroba Alzheimera
Choroba Alzheimera (AD) jest chorobą neurodegeneracyjną charakteryzującą się zaburzeniami funkcji poznawczych i pamięci, które uważa się za wynik powstawania w mózgu zarówno blaszek starczych zawierających amyloid-β (Aβ), jak i splątań neurofibrylarnych zawierających białko tau związane z mikrotubulami. Dowody sugerują więc, że szlaki sygnalizacyjne MAPK mogą przyczyniać się do patogenezy AD poprzez regulację apoptozy neuronów, aktywności β- i γ-sekretazy oraz fosforylacji APP i tau.
– Choroba Parkinsona
Choroba Parkinsona (PD) jest drugą co do częstości występowania chorobą neurodegeneracyjną. Różne obserwacje sugerują, że szlaki sygnalizacji MAPK przyczyniają się do odpowiedzi neurozapalnej i śmierci neuronów wywołanych przez agregaty α-synukleiny lub funkcjonalne niedobory parkiny lub DJ-1 w patogenezie choroby Parkinsona.
– Sygnalizacja MAPK w nowotworach
Wiele mutacji komponentów szlaków sygnalizacji MAPK związanych z nowotworami znaleziono w Ras i B-Raf, które uczestniczą w szlaku sygnalizacji ERK. Szlak sygnalizacyjny ERK odgrywa rolę w kilku etapach rozwoju nowotworu. Fosforylacja przez ERK białek takich jak kinaza łańcucha lekkiego miozyny, kalpaina, kinaza adhezji ogniskowej i paksylina promuje migrację komórek nowotworowych. Ponadto, sygnalizacja ERK1/2 reguluje aktywność i poziom białek rodziny Bcl-2, takich jak pro-apoptotyczne białko BIM i anty-apoptotyczne białko MCL-1, promując w ten sposób przeżycie komórek nowotworowych.
| Keshet Y, Seger R. The MAP kinase signaling cascades: a system of hundreds of components regulates a diverse array of physiological functions. MAP Kinase Signaling Protocols: Second Edition, 2010: 3-38. | |
| Wortzel I, Seger R. The ERK cascade distinct functions within various subcellular organelles. Genes & cancer, 2011, 2(3): 195-209. | |
| Ramos J W. The regulation of extracellular signal-regulated kinase (ERK) in mammalian cells. The international journal of biochemistry & cell biology, 2008, 40(12): 2707-2719. | |
| Shaul Y D, Seger R. The MEK/ERK cascade: from signaling specificity to diverse functions. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2007, 1773(8): 1213-1226. | |
| Yao Z, Seger R. The ERK signaling cascade—views from different subcellular compartments. Biofactors, 2009, 35(5): 407-416. |