Ładunki formalne
Cząsteczki organiczne mogą mieć również dodatnie lub ujemne ładunki związane z nimi. Podczas reakcji chemicznych, powszechne jest posiadanie ładunku reaktora, produktów pośrednich, i/lub produktów. Rozpoznanie i rozróżnienie pomiędzy neutralnymi i naładowanymi wzorami wiązań będzie pomocne w nauce mechanizmów reakcji. Rozważmy strukturę Lewisa metanolu, CH3OH (metanol jest tak zwanym „alkoholem drzewnym”, który bez skrupułów był sprzedawany w czasach prohibicji w latach 20-tych, często powodując ślepotę u ludzi, którzy go pili). Sam metanol jest cząsteczką neutralną, ale może stracić proton i stać się anionem molekularnym (CH3O-) lub zyskać proton i stać się kationem molekularnym (CH3OH2+).

Anion molekularny i kation molekularny mają ładunki całkowite odpowiednio -1 i +1. Ale możemy być bardziej szczegółowi – możemy również stwierdzić dla każdego jonu molekularnego, że ładunek formalny jest zlokalizowany konkretnie na atomie tlenu, a nie na atomie węgla lub któregokolwiek z atomów wodoru.
Określenie ładunku formalnego na różnych atomach cząsteczki jest prostym procesem – jest to po prostu kwestia zsumowania elektronów walencyjnych.
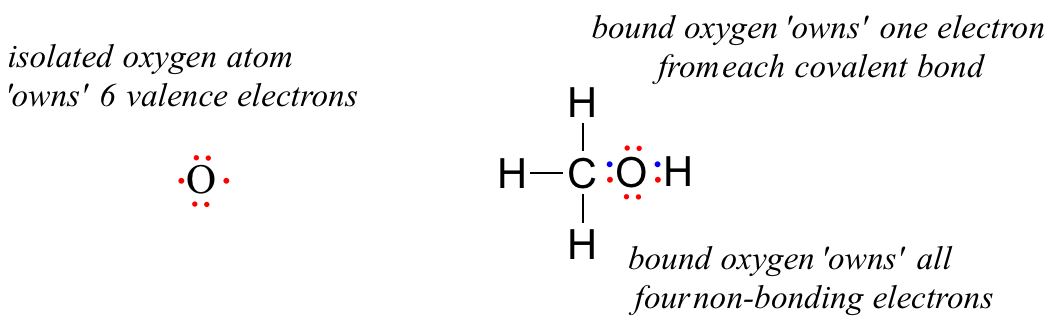
Niezwiązany atom tlenu ma 6 elektronów walencyjnych. Kiedy jednak jest związany jako część cząsteczki metanolu, atom tlenu jest otoczony przez 8 elektronów walencyjnych: 4 elektrony niezwiązane (dwie „samotne pary”) i 2 elektrony w każdym z dwóch wiązań kowalencyjnych (jedno z węglem, jedno z wodorem). W konwencji ładunku formalnego mówimy, że tlen „posiada” wszystkie 4 elektrony niezwiązane. Jednakże, „posiada” on tylko jeden elektron z każdego z dwóch wiązań kowalencyjnych, ponieważ wiązania kowalencyjne polegają na wymianie elektronów pomiędzy atomami. Zatem atom tlenu w metanolu posiada 2 + 2 + (½ x 4) = 6 elektronów walencyjnych.
The formal charge on an atom is calculated as the number of valence electrons owned by the isolated atom minus the number of valence electrons owned by the bound atom in the molecule:
Determining formal charge on an atom
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of valence electrons owned by the bound atom)
or . . .
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of non-bonding electrons on the bound atom)
– ( ½ the number of bonding electrons on the bound atom)
Using this formula for the oxygen atom of methanol, we have:
formal charge on oxygen =
(6 valence electrons on isolated atom)
– (4 non-bonding electrons)
– (½ x 4 bonding electrons)
= 6 – 4 – 2 = 0. Thus, oxygen in methanol has a formal charge of zero (in other words, it has no formal charge).
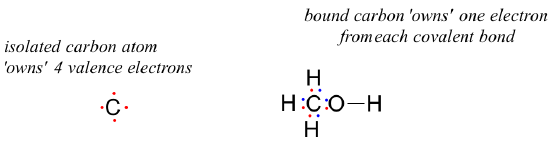
How about the carbon atom in methanol? An isolated carbon owns 4 valence electrons. The bound carbon in methanol owns (½ x 8) = 4 valence electrons:
formal charge on carbon =
(4 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 8 bonding electrons)
= 4 – 0 – 4 = 0. So the formal charge on carbon is zero.
For each of the hydrogens in methanol, we also get a formal charge of zero:
formal charge on hydrogen =
(1 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 2 bonding electrons)
= 1 – 0 – 1 = 0
Now, let’s look at the cationic form of methanol, CH3OH2+. The bonding picture has not changed for carbon or for any of the hydrogen atoms, so we will focus on the oxygen atom.
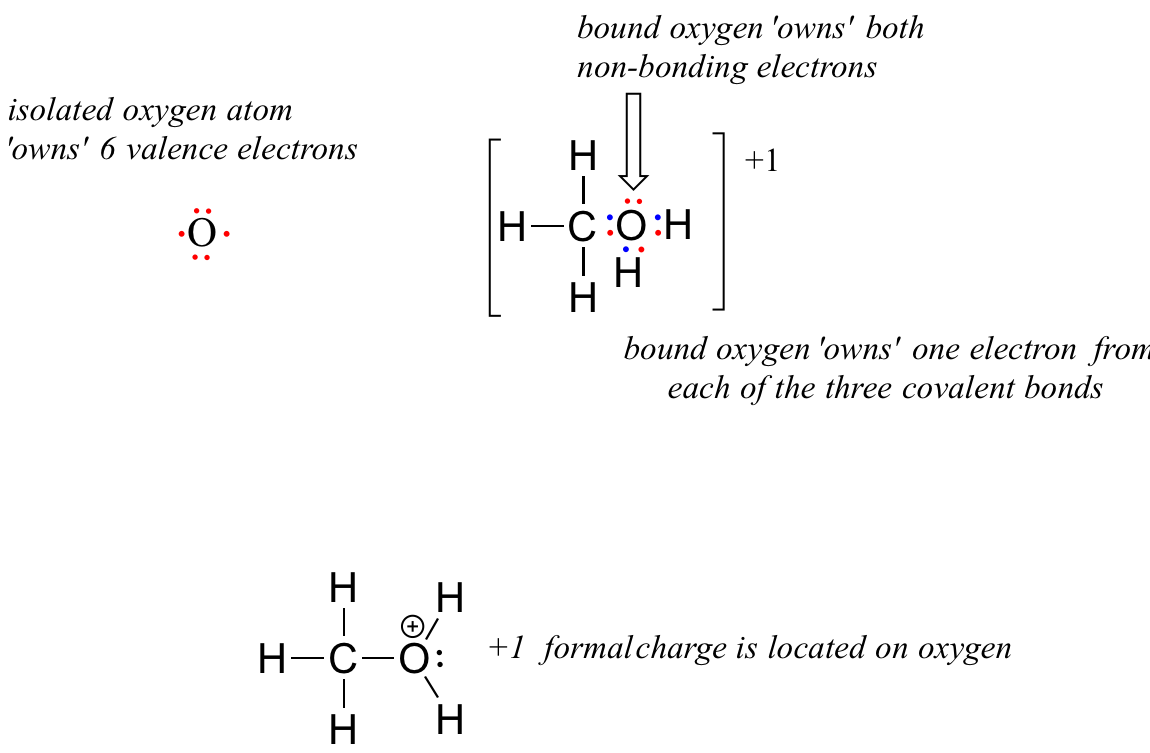
The oxygen owns 2 non-bonding electrons and 3 bonding elections, so the formal charge calculations becomes:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (2 non-bonding electrons)
– (½ x 6 bonding electrons)
= 6 – 2 – 3 = 1. A formal charge of +1 is located on the oxygen atom.
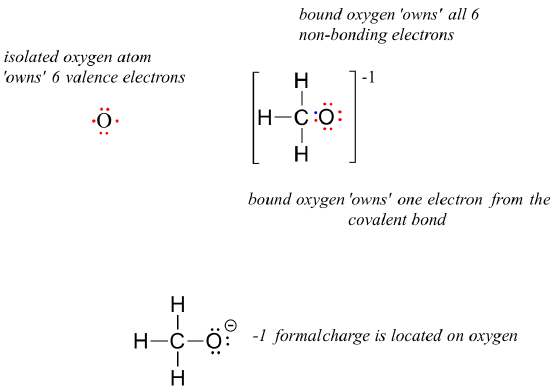
For methoxide, the anionic form of methanol, the calculation for the oxygen atom is:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (6 non-bonding electrons)
– (½ x 2 bonding electrons)
= 6 – 6 – 1 = -1. A formal charge of -1 is located on the oxygen atom.
A very important rule to keep in mind is that the sum of the formal charges on all atoms of a molecule must equal the net charge on the whole molecule.
Przy rysowaniu struktur cząsteczek organicznych bardzo ważne jest pokazanie wszystkich niezerowych ładunków formalnych, z wyraźnym zaznaczeniem, gdzie te ładunki się znajdują. Struktura, w której brakuje niezerowych ładunków formalnych, nie jest poprawnie narysowana i prawdopodobnie zostanie tak oceniona na egzaminie!
W tym momencie, myśląc o tym, czego nauczyłeś się w chemii ogólnej, prawdopodobnie pytasz: „A co z dipolami? Czy atom tlenu w wiązaniu O-H nie „posiada” więcej gęstości elektronowej niż wodór, z powodu jego większej neutralności elektronowej?” Jest to całkowicie poprawne, a my zajmiemy się koncepcją dipoli wiązań w dalszej części tego rozdziału. Dla celów obliczania ładunków formalnych, dipole wiązań nie mają jednak znaczenia – zawsze uważamy, że dwa elektrony w wiązaniu są dzielone równo, nawet jeśli nie jest to dokładne odzwierciedlenie rzeczywistości chemicznej. Ładunki formalne są właśnie tym – formalnością, metodą księgowania elektronów, która jest powiązana z systemem Lewisa służącym do rysowania struktur związków organicznych i jonów. Później zobaczymy, jak pojęcie ładunku formalnego może nam pomóc w wizualizacji reakcji cząsteczek organicznych.
Na koniec, nie dajcie się zwieść myśleniu, że tylko dlatego, że ładunek netto w strukturze wynosi zero, nie ma atomów z ładunkami formalnymi: jeden atom może mieć dodatni ładunek formalny, a drugi ujemny, a ładunek netto nadal będzie wynosił zero. Zwitteriony, takie jak aminokwasy, mają zarówno dodatnie, jak i ujemne ładunki formalne na różnych atomach:

Nawet jeśli ładunek netto na glicynie wynosi zero, nadal konieczne jest pokazanie położenia dodatnich i ujemnych ładunków formalnych.
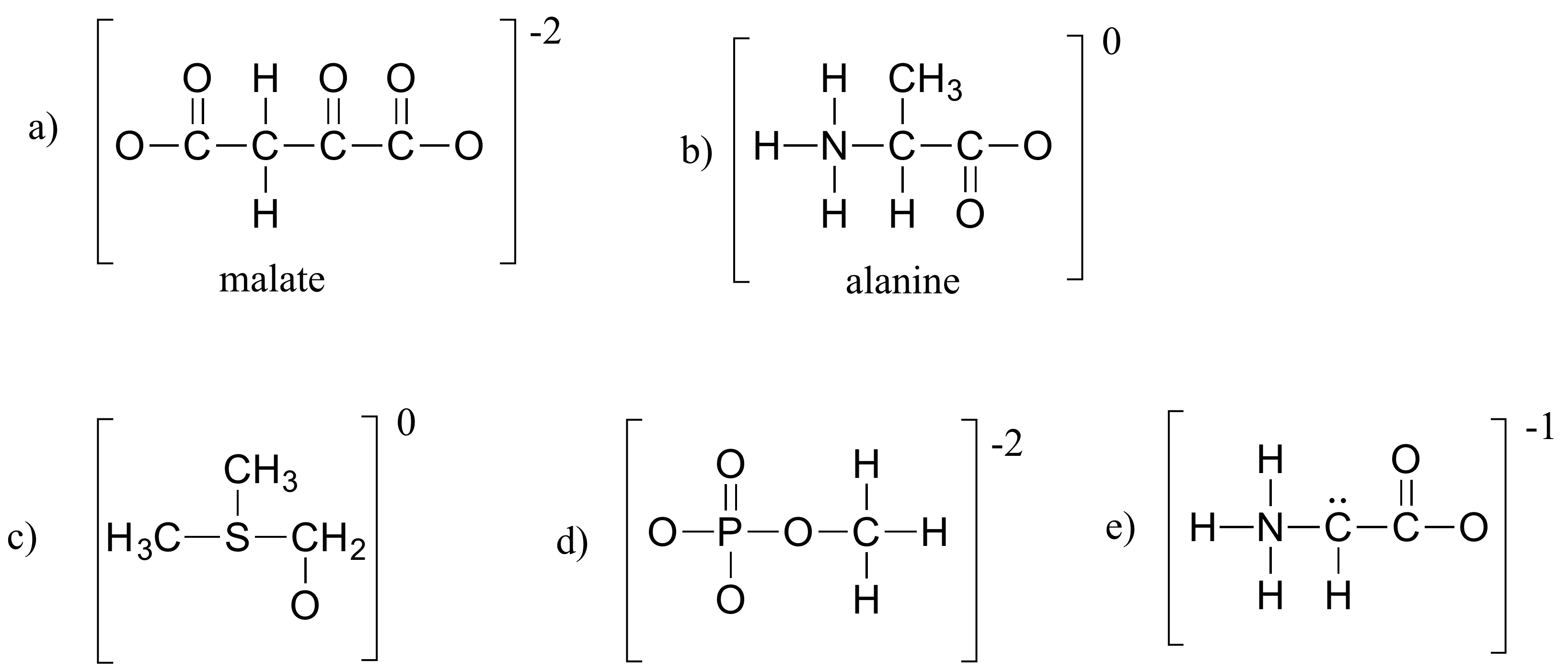
Ćwiczenie 1.4
Wypełnij wszystkie brakujące elektrony samotnej pary i ładunki formalne w poniższych strukturach. Przyjmij, że wszystkie atomy posiadają kompletną powłokę walencyjną elektronów. Ładunki netto są pokazane poza nawiasami.
Rozwiązania do ćwiczeń