Elektronegatywność i polarność wiązania
Mimo, że zdefiniowaliśmy wiązanie kowalencyjne jako dzielenie się elektronami, elektrony w wiązaniu kowalencyjnym nie zawsze są dzielone równo przez dwa atomy wiązania. Jeżeli wiązanie nie łączy dwóch atomów tego samego pierwiastka, tak jak w H2, zawsze będzie jeden atom, który przyciąga elektrony w wiązaniu silniej niż drugi atom, tak jak w HCl, pokazanym na rysunku \(\PageIndex{1}\). Wiązanie kowalencyjne, które ma równy podział elektronów (Rysunek \PageIndex{1a}}) jest nazywane niepolarnym wiązaniem kowalencyjnym. Wiązanie kowalencyjne, które ma nierówny podział elektronów, jak na rysunku (\PageIndex{1b}}), nazywamy kowalencyjnym wiązaniem polarnym.

Rozkład gęstości elektronów w wiązaniu polarnym jest nierównomierny. Jest ona większa wokół atomu, który przyciąga elektrony bardziej niż inny. Na przykład, elektrony w wiązaniu H-Cl cząsteczki chlorowodoru spędzają więcej czasu w pobliżu atomu chloru niż w pobliżu atomu wodoru. Zauważ, że zacieniony obszar wokół Cl na rysunku jest znacznie większy niż wokół H.
Ta nierównowaga w gęstości elektronów skutkuje nagromadzeniem częściowego ładunku ujemnego (oznaczonego jako δ-) po jednej stronie wiązania (Cl) i częściowego ładunku dodatniego (oznaczonego δ+) po drugiej stronie wiązania (H). Widać to na rysunku ¨(¨PageIndex{2a}¨). Rozdzielenie ładunku w polarnym wiązaniu kowalencyjnym powoduje powstanie dipola elektrycznego (dwóch biegunów), przedstawionego strzałką na rysunku (\PageIndex{2b}}). Kierunek strzałki jest skierowany w stronę końca δ-, podczas gdy ogon + strzałki wskazuje na koniec δ+ wiązania.
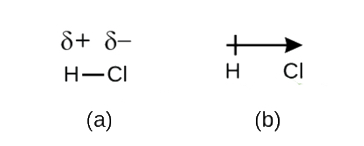
Rysunek \(\PageIndex{2}}): (a) Nierówny podział wiążącej pary elektronów pomiędzy H i Cl prowadzi do częściowego naładowania dodatniego atomu H i częściowego naładowania ujemnego atomu Cl. Symbole δ+ i δ- wskazują biegunowość wiązania H-Cl. (b) Dipol jest reprezentowany przez strzałkę z krzyżykiem na ogonie. Krzyż znajduje się w pobliżu końca δ+, a grot strzałki pokrywa się z końcem δ-.
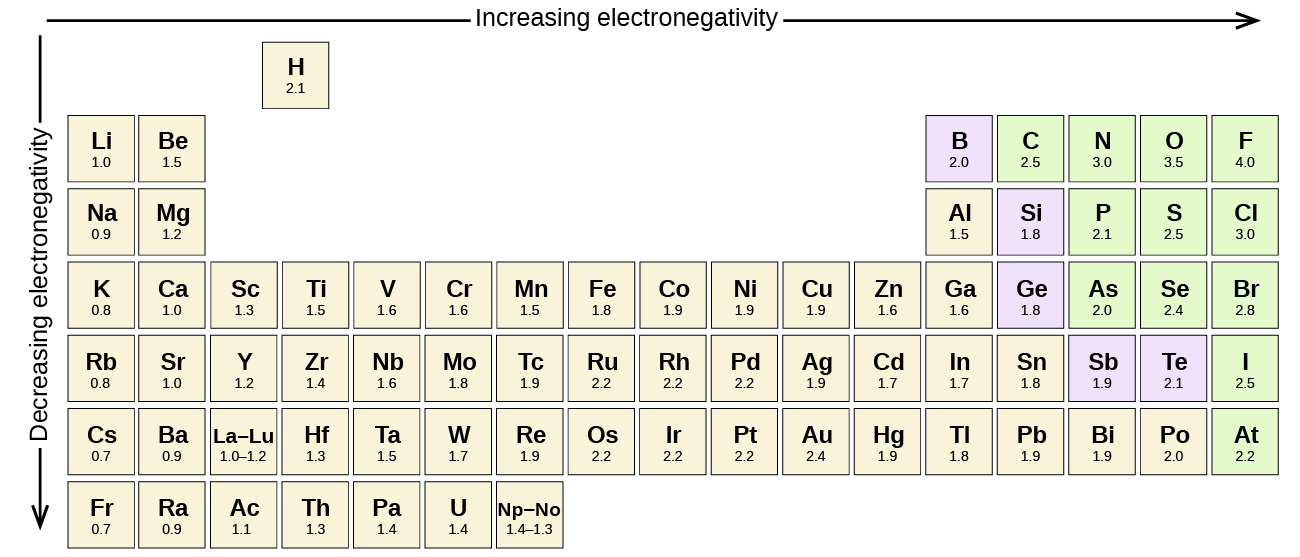
Każde wiązanie kowalencyjne pomiędzy atomami różnych pierwiastków jest wiązaniem polarnym, ale stopień polarności jest bardzo różny. Niektóre wiązania pomiędzy różnymi pierwiastkami są tylko minimalnie polarne, podczas gdy inne są silnie polarne. Wiązania jonowe mogą być uważane za najbardziej polarne, w których elektrony są raczej przenoszone niż dzielone. Aby ocenić względną polarność wiązania kowalencyjnego, chemicy używają elektronegatywności, która jest względną miarą tego, jak silnie atom przyciąga elektrony, gdy tworzy wiązanie kowalencyjne. Istnieją różne skale numeryczne do oceny elektroujemności. Rysunek przedstawia jedną z najbardziej popularnych – skalę Paulinga.
Patrząc bliżej: Linus Pauling
Prawdopodobnie najbardziej wpływowy chemik XX wieku, Linus Pauling (1901-94) jest jedyną osobą, która zdobyła dwie indywidualne (czyli nie dzielone) Nagrody Nobla. W latach trzydziestych Pauling wykorzystał nowe teorie matematyczne do sformułowania kilku podstawowych zasad dotyczących wiązań chemicznych. Jego książka „The Nature of the Chemical Bond” z 1939 r. jest jedną z najważniejszych książek opublikowanych w chemii.
W 1935 r. Pauling zainteresował się cząsteczkami biologicznymi i otrzymał Nagrodę Nobla w dziedzinie chemii w 1954 r. za pracę nad strukturą białek. (Był bardzo bliski odkrycia struktury podwójnej helisy DNA, kiedy James Watson i James Crick ogłosili swoje własne odkrycie jej struktury w 1953 r.). Później otrzymał Pokojową Nagrodę Nobla w 1962 roku za swoje wysiłki na rzecz zakazu testowania broni jądrowej.

Linus Pauling był jednym z najbardziej wpływowych chemików XX wieku.
W późniejszych latach Pauling stał się przekonany, że duże dawki witaminy C zapobiegną chorobom, w tym przeziębieniu. Większość badań klinicznych nie wykazała związku, ale Pauling kontynuował codzienne przyjmowanie dużych dawek. Zmarł w 1994 r., spędziwszy całe życie na tworzeniu spuścizny naukowej, której niewielu będzie w stanie dorównać.
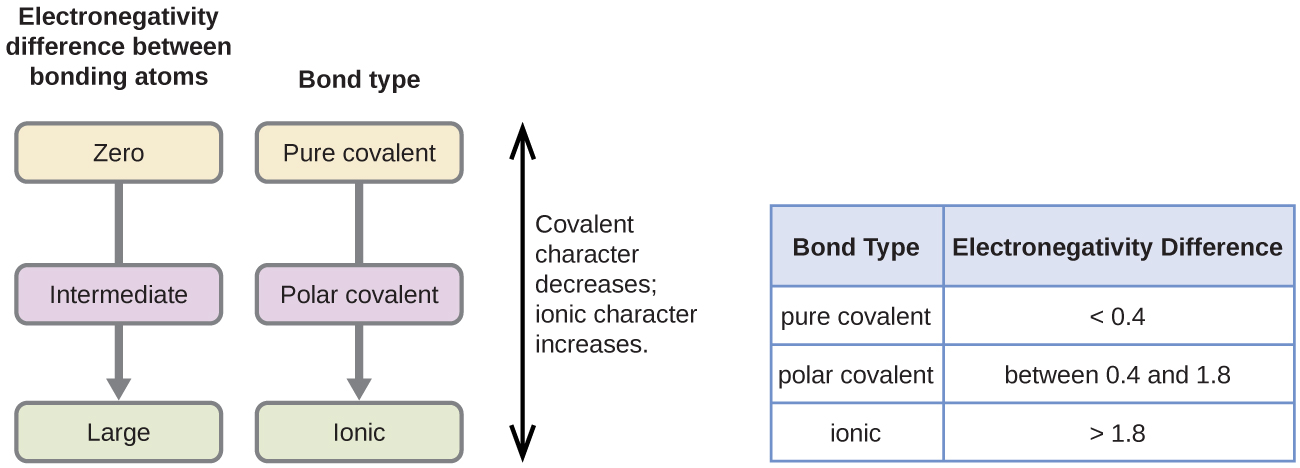
Polaryzacja wiązania kowalencyjnego może być oceniana poprzez określenie różnicy w elektroujemności dwóch atomów tworzących wiązanie. Im większa różnica w electronegativities, tym większa nierównowaga podziału elektronów w wiązaniu. Chociaż nie ma twardych i szybkich reguł, ogólna zasada jest, jeśli różnica w electronegativities jest mniejsza niż około 0,4, wiązanie jest uważane za niepolarne; jeśli różnica jest większa niż 0,4, wiązanie jest uważane za polarne. Jeśli różnica w elektronegatywności jest wystarczająco duża (zazwyczaj większa niż około 1,8), otrzymany związek jest uważany za jonowy, a nie kowalencyjny. Różnica elektronegatywności równa zero, oczywiście, wskazuje na niepolarne wiązanie kowalencyjne.
Przykład(‖)
Opisać różnicę elektronegatywności pomiędzy każdą parą atomów i wynikającą z tego polaryzację (lub typ wiązania).
- C i H
- H i H
- Na i Cl
- O i H
Rozwiązanie
- Węgiel ma elektronegatywność 2,5, podczas gdy wartość dla wodoru wynosi 2,1. Różnica wynosi 0,4, czyli jest raczej niewielka. Wiązanie C-H jest zatem uważane za niepolarne.
- Oba atomy wodoru mają tę samą wartość elektronegatywności-2,1. Różnica wynosi zero, więc wiązanie jest niepolarne.
- Elektronegatywność sodu wynosi 0,9, a chloru 3,0. Różnica wynosi 2,1, który jest dość wysoki, a więc sodu i chloru tworzą związek jonowy.
- Z 2,1 dla wodoru i 3,5 dla tlenu, różnica elektronegatywności jest 1,4. Spodziewalibyśmy się bardzo polarne wiązanie. The sharing of electrons between O and H is unequal with the electrons more strongly drawn towards O.
Exercise \(\PageIndex{1}\)
Describe the electronegativity (EN) difference between each pair of atoms and the resulting polarity (or bond type).
- C and O
- K and Br
- N and N
- Cs and F
Answer a:
The EN difference is 1.0 , hence polar. The sharing of electrons between C and O is unequal with the electrons more strongly drawn towards O.
Answer b:
The EN difference is greater than 1.8, hence ionic.
Answer c:
Identical atoms have zero EN difference, hence nonpolar.
Answer d:
The EN difference is greater than 1.8, hence ionic.