Dosage Form: powder for oral suspension
Medically reviewed by Drugs.com. Last updated on April 1, 2019.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
- INDICATIONS & USAGE
- Respiratory Tract Infections
- Otitis Media
- Zakażenia skóry i struktur skórnych
- Zakażenia kości
- Zakażenia dróg moczowo-płciowych
- Stosowanie
- DAWKOWANIE & ADMINISTRACJA
- Dorośli i pacjenci pediatryczni w wieku co najmniej 15 lat
- Pacjenci pediatryczni (powyżej 1 roku życia)
- Dosage Adjustments in Adult and Pediatric Patients at Least Least 15 Years of Age with Renal Impairment
- FORMY DAWKOWANIA & SKŁADNIKI
- Przeciwwskazania
- Ostrzeżenia i środki ostrożności
- Reakcje nadwrażliwości
- Biegunka związana z Clostridium difficile
- Serokonwersja w bezpośrednich testach Coombsa
- Potencjał wywołania drgawek
- Przedłużony czas protrombinowy
- Rozwój bakterii lekoopornych
- Działania niepożądane
- Doświadczenia z badań klinicznych
- Interakcje lekowe
- Metformina
- Probenecyd
- Interakcje z badaniami laboratoryjnymi lub diagnostycznymi
- STOSOWANIE W SZCZEGÓLNYCH POPULACJACH
- Ciąża
- Karmiące matki
- Stosowanie u dzieci
- Stosowanie u osób w podeszłym wieku
- Niedobory czynności nerek
- Przedawkowanie
- Opis zawiesiny cefaleksyny
- Cefaleksyna zawiesina – farmakologia kliniczna
- Mechanizm działania
- Farmakokinetyka
- Mikrobiologia
- Nonclinical Toxicology
- Carcinogenesis & Mutagenesis & Impairment Of Fertility
- How Supplied/Storage and Handling
- Informacje dla pacjenta
- PACKAGE LABEL.PRINCIPAL DISPLAY PANEL
- Frequently asked questions
- More about cephalexin
- Consumer resources
- Professional resources
- Related treatment guides
INDICATIONS & USAGE
Respiratory Tract Infections
Cephalexin is indicated for the treatment of respiratory tract infections caused by susceptible isolates of Streptococcus pneumoniae and Streptococcus pyogenes.
Otitis Media
Cephalexin is indicated for the treatment of otitis media caused by susceptible isolates of Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus, Streptococcus pyogenes, and Moraxella catarrhalis.
Zakażenia skóry i struktur skórnych
Cefaleksyna jest wskazana w leczeniu zakażeń skóry i struktur skórnych wywołanych przez wrażliwe izolaty następujących bakterii Gram-dodatnich: Staphylococcus aureus i Streptococcus pyogenes.
Zakażenia kości
Cefaleksyna jest wskazana w leczeniu zakażeń kości wywołanych przez wrażliwe izolaty Staphylococcus aureus i Proteus mirabilis.
Zakażenia dróg moczowo-płciowych
Cefaleksyna jest wskazana w leczeniu zakażeń dróg moczowo-płciowych, w tym ostrego zapalenia gruczołu krokowego, wywołanych przez wrażliwe izolaty Escherichia coli, Proteus mirabilis i Klebsiella pneumoniae.
Stosowanie
Aby ograniczyć rozwój bakterii lekoopornych i utrzymać skuteczność cefaleksyny i innych leków przeciwbakteryjnych, cefaleksynę należy stosować wyłącznie w leczeniu zakażeń, co do których udowodniono lub istnieje poważne podejrzenie, że są wywołane przez wrażliwe bakterie. Jeśli dostępne są informacje na temat hodowli i wrażliwości bakterii, należy je uwzględnić przy wyborze lub modyfikacji terapii przeciwbakteryjnej. W przypadku braku takich danych, lokalna epidemiologia i schematy wrażliwości mogą przyczynić się do empirycznego wyboru terapii.
DAWKOWANIE & ADMINISTRACJA
Dorośli i pacjenci pediatryczni w wieku co najmniej 15 lat
Zwyczajowa dawka doustnej cefaleksyny wynosi 250 mg co 6 godzin, ale można stosować dawkę 500 mg co 12 godzin. Leczenie prowadzi się przez 7 do 14 dni.
W przypadku cięższych zakażeń mogą być konieczne większe dawki doustnej cefaleksyny, do 4 gramów na dobę w dwóch do czterech równych dawkach podzielonych.
Pacjenci pediatryczni (powyżej 1 roku życia)
Zalecana całkowita dawka dobowa doustnej cefaleksyny dla pacjentów pediatrycznych wynosi 25 do 50 mg/kg mc. podawana w równych dawkach podzielonych przez 7 do 14 dni. W leczeniu zakażeń wywołanych przez paciorkowce β-hemolizujące zalecany jest co najmniej 10-dniowy okres leczenia. In severe infections, a total daily dose of 50 to 100 mg/kg may be administered in equally divided doses.
For the treatment of otitis media, the recommended daily dose is 75 to 100 mg/kg given in equally divided doses.
| Weight 10 kg (22 lb) 20 kg (44 lb) 40 kg (88 lb) |
Cephalexin Suspension 125mg/5mL ½ to 1 tsp q.i.d. 1 to 2 tsp q.i.d. 2 to 4 tsp q.i.d. |
250mg/5mL ¼ to ½ tsp q.i.d. ½ to 1 tsp q.i.d. 1 to 2 tsp q.i.d. |
| Weight 10 kg (22 lb) 20 kg (44 lb) 40 kg (88 lb) |
125mg/5mL 1 to 2 tsp b.i.d. 2 to 4 tsp b.i.d. 4 to 8 tsp b.i.d. |
250mg/5mL ½ to 1 tsp b.i.d 1 to 2 tsp b.i.d. 2 to 4 tsp b.i.d. |
Sposób użycia
125 mg na 5 mL (100 mL po zmieszaniu): Przygotować czas zawiesiny przy wydawaniu. Dodać do butelki łącznie 67 mL wody. Aby ułatwić przygotowanie zawiesiny, należy zakręcić butelkę w celu poluzowania proszku, dodać wodę w 2 porcjach, dobrze wstrząsając po każdym dodaniu. Otrzymana zawiesina będzie zawierała cefaleksynę jednowodną w ilości odpowiadającej 125 mg cefaleksyny w każdych 5 mL (łyżeczce).
125 mg na 5 mL (200 mL po zmieszaniu): Przygotować czas zawieszenia przy wydawaniu. Dodać do butelki łącznie 134 mL wody. Aby ułatwić przygotowanie, należy zakręcić butelkę w celu rozluźnienia proszku, dodać wodę w 2 porcjach, dobrze wstrząsając po każdym dodaniu. Otrzymana zawiesina będzie zawierała cefaleksynę jednowodną w ilości odpowiadającej 125 mg cefaleksyny w każdych 5 mL (łyżeczce).
250 mg na 5 mL (100 mL po zmieszaniu): Przygotować czas przygotowania zawiesiny przy wydawaniu. Dodać do butelki łącznie 67 mL wody. Aby ułatwić przygotowanie zawiesiny, należy zakręcić butelkę w celu rozluźnienia proszku, dodać wodę w 2 porcjach, dobrze wstrząsając po każdym dodaniu. Otrzymana zawiesina będzie zawierała cefaleksynę jednowodną w ilości odpowiadającej 250 mg cefaleksyny w każdych 5 mL (łyżeczce).
250 mg na 5 mL (200 mL po zmieszaniu): Przygotować czas przygotowania zawiesiny przy wydawaniu. Dodać do butelki łącznie 134 mL wody. Aby ułatwić przygotowanie zawiesiny, należy zakręcić butelkę w celu rozluźnienia proszku, dodać wodę w 2 porcjach, dobrze wstrząsając po każdym dodaniu. Otrzymana zawiesina będzie zawierała cefaleksynę jednowodną w ilości odpowiadającej 250 mg cefaleksyny w każdych 5 mL (łyżeczce).
*Po wymieszaniu przechowywać w lodówce. Może być przechowywany przez 14 dni bez znaczącej utraty mocy.
Dosage Adjustments in Adult and Pediatric Patients at Least Least 15 Years of Age with Renal Impairment
Podawać następujące schematy dawkowania cefaleksyny pacjentom z zaburzoną czynnością nerek .
Tabela 1. Recommended Dose Regimen for Patients with Renal Impairment
| Renal function | Dose regimen recommendation |
| Creatinine clearance ≥60 mL/min | No dose adjustment |
| Creatinine clearance 30 to 59 mL/min | No dose adjustment; maximum daily dose should not exceed 1 g |
| Creatinine clearance 15 to 29 mL/min | 250 mg, every 8 hours or every 12 hours |
| Creatinine clearance 5 to 14 mL/min not yet on dialysis* | 250 mg, every 24 hours |
| Creatinine clearance 1 to 4 mL/min not yet on dialysis* | 250 mg, co 48 godzin lub co 60 godzin |
*Brak wystarczających informacji do sformułowania zaleceń dotyczących dostosowania dawki u pacjentów poddawanych hemodializie.
FORMY DAWKOWANIA & SKŁADNIKI
Cephalexin For Oral Suspension USP
125 mg/5 ml i 250 mg/5 ml
Przeciwwskazania
Cefaleksyna jest przeciwwskazana u pacjentów ze znaną nadwrażliwością na cefaleksynę lub innych członków klasy cefalosporynowych leków przeciwbakteryjnych.
Ostrzeżenia i środki ostrożności
Reakcje nadwrażliwości
Zgłaszano występowanie reakcji alergicznych w postaci wysypki, pokrzywki, obrzęku naczynioruchowego, anafilaksji, rumienia wielopostaciowego, zespołu Stevensa-Johnsona lub toksycznej nekrolizy naskórka podczas stosowania cefaleksyny. Przed rozpoczęciem leczenia cefaleksyną należy dowiedzieć się, czy u pacjenta nie występowały w przeszłości reakcje nadwrażliwości na cefaleksynę, cefalosporyny, penicyliny lub inne leki. Nadwrażliwość krzyżowa wśród beta-laktamowych leków przeciwbakteryjnych może wystąpić do 10% pacjentów z alergią na penicyliny w wywiadzie.
Jeśli wystąpi reakcja alergiczna na cefaleksynę, należy odstawić lek i wdrożyć odpowiednie leczenie.
Biegunka związana z Clostridium difficile
Biegunka związana z Clostridium difficile (CDAD) była zgłaszana podczas stosowania prawie wszystkich leków przeciwbakteryjnych, w tym cefaleksyny, i może mieć różne nasilenie, od łagodnej biegunki do śmiertelnego zapalenia jelita grubego. Leczenie środkami przeciwbakteryjnymi zmienia normalną florę jelita grubego, prowadząc do nadmiernego wzrostu C. difficile.
C. difficile wytwarza toksyny A i B, które przyczyniają się do rozwoju CDAD. Szczepy C. difficile wytwarzające hipertoksyny powodują zwiększoną zachorowalność i śmiertelność, ponieważ infekcje te mogą być oporne na leczenie przeciwbakteryjne i mogą wymagać kolektomii. CDAD należy brać pod uwagę u wszystkich pacjentów, którzy zgłaszają się z biegunką po zastosowaniu antybiotyków. Konieczne jest zebranie dokładnego wywiadu, ponieważ CDAD może wystąpić po ponad dwóch miesiącach od podania środków przeciwbakteryjnych.
Jeśli podejrzewa się lub potwierdza CDAD, konieczne może być przerwanie ciągłego stosowania antybiotyków, które nie są przeznaczone do zwalczania C. difficile. Zgodnie ze wskazaniami klinicznymi należy wdrożyć odpowiednią gospodarkę płynami i elektrolitami, suplementację białkową, leczenie antybiotykami C. difficile oraz ocenę chirurgiczną.
Serokonwersja w bezpośrednich testach Coombsa
Podczas leczenia lekami przeciwbakteryjnymi z grupy cefalosporyn, w tym cefaleksyną, odnotowano dodatnie wyniki bezpośrednich testów Coombsa. Zgłaszano przypadki ostrej hemolizy wewnątrznaczyniowej wywołanej leczeniem cefaleksyną. Jeśli w trakcie lub po zakończeniu leczenia cefaleksyną wystąpi niedokrwistość, należy przeprowadzić diagnostykę w kierunku niedokrwistości hemolitycznej wywołanej lekiem, odstawić cefaleksynę i wdrożyć odpowiednie leczenie.
Potencjał wywołania drgawek
Kilka cefalosporyn może wywoływać drgawki, szczególnie u pacjentów z zaburzeniami czynności nerek, u których nie zmniejszono dawki leku. W przypadku wystąpienia drgawek należy odstawić cefaleksynę. Można zastosować leczenie przeciwdrgawkowe, jeśli jest to wskazane klinicznie.
Przedłużony czas protrombinowy
Cefalosporyny mogą być związane z wydłużeniem czasu protrombinowego. Do osób z grup ryzyka należą pacjenci z zaburzeniami czynności nerek, wątroby lub ze złym stanem odżywienia, a także pacjenci otrzymujący przedłużone leczenie przeciwbakteryjne i pacjenci otrzymujący leki przeciwzakrzepowe. U pacjentów z grupy ryzyka należy monitorować czas protrombinowy i postępować zgodnie ze wskazaniami.
Rozwój bakterii lekoopornych
Przepisanie cefaleksyny w przypadku braku potwierdzonego lub silnie podejrzewanego zakażenia bakteryjnego prawdopodobnie nie przyniesie korzyści pacjentowi i zwiększa ryzyko rozwoju bakterii lekoopornych.
Długotrwałe stosowanie cefaleksyny może prowadzić do nadmiernego wzrostu organizmów niewrażliwych. Niezbędna jest uważna obserwacja pacjenta. Jeśli podczas leczenia wystąpi nadkażenie, należy podjąć odpowiednie środki zaradcze.
Działania niepożądane
Następujące ciężkie zdarzenia zostały opisane bardziej szczegółowo w punkcie Ostrzeżenia i środki ostrożności:
– Reakcje nadwrażliwości
– Biegunka związana z Clostridium difficile
– Serokonwersja w bezpośrednim teście Coombsa
– Potencjał drgawkowy
– Wpływ na aktywność protrombiny
– Rozwój bakterii opornych na lek
Doświadczenia z badań klinicznych
Ponieważ badania kliniczne są prowadzone w bardzo zróżnicowanych warunkach, częstości działań niepożądanych obserwowanych w badaniach klinicznych danego leku nie można bezpośrednio porównywać z częstościami obserwowanymi w badaniach klinicznych innego leku i mogą one nie odzwierciedlać częstości obserwowanych w praktyce.
W badaniach klinicznych najczęstszym działaniem niepożądanym była biegunka. Występowały również nudności i wymioty, dyspepsja, zapalenie błony śluzowej żołądka i ból brzucha. Podobnie jak w przypadku penicylin i innych cefalosporyn, zgłaszano przemijające zapalenie wątroby i żółtaczkę cholestatyczną.
Inne działania niepożądane obejmowały reakcje nadwrażliwości, świąd narządów płciowych i odbytu, kandydozę narządów płciowych, zapalenie pochwy i upławy z pochwy, zawroty głowy, zmęczenie, ból głowy, pobudzenie, splątanie, omamy, bóle stawów, zapalenie stawów i zaburzenia stawów. Zgłaszano występowanie odwracalnego śródmiąższowego zapalenia nerek. Zgłaszano eozynofilię, neutropenię, trombocytopenię, niedokrwistość hemolityczną i niewielkie zwiększenie aktywności aminotransferazy asparaginianowej (AST) i alaninowej (ALT).
Oprócz wymienionych powyżej działań niepożądanych, które obserwowano u pacjentów leczonych cefaleksyną, zgłaszano następujące działania niepożądane i inne zmienione wyniki badań laboratoryjnych dla leków przeciwbakteryjnych z grupy cefalosporyn:
Inne działania niepożądane: Gorączka, zapalenie okrężnicy, niedokrwistość aplastyczna, krwotok, zaburzenia czynności nerek i nefropatia toksyczna.
Zmiany w wynikach badań laboratoryjnych: Wydłużony czas protrombinowy, zwiększone stężenie azotu mocznikowego we krwi (BUN), zwiększone stężenie kreatyniny, zwiększone stężenie fosfatazy zasadowej, zwiększone stężenie bilirubiny, zwiększone stężenie dehydrogenazy mleczanowej (LDH), pancytopenia, leukopenia i agranulocytoza.
Interakcje lekowe
Metformina
Podawanie cefaleksyny z metforminą powoduje zwiększenie stężenia metforminy w osoczu i zmniejszenie klirensu nerkowego metforminy.
U pacjentów przyjmujących jednocześnie cefaleksynę i metforminę zaleca się uważne monitorowanie pacjentów i dostosowanie dawki metforminy.
Probenecyd
Nerkowe wydalanie cefaleksyny jest hamowane przez probenecyd. Nie zaleca się jednoczesnego podawania probenecydu z cefaleksyną.
Interakcje z badaniami laboratoryjnymi lub diagnostycznymi
Może wystąpić reakcja fałszywie dodatnia podczas badania na obecność glukozy w moczu z użyciem roztworu Benedicta lub roztworu Fehlinga.
STOSOWANIE W SZCZEGÓLNYCH POPULACJACH
Ciąża
Kategoria B
Brak odpowiednich i dobrze kontrolowanych badań u kobiet w ciąży. Ponieważ badania nad rozrodczością zwierząt nie zawsze pozwalają przewidzieć odpowiedź u ludzi, lek ten powinien być stosowany w okresie ciąży tylko w przypadku zdecydowanej konieczności.
Badania nad rozrodczością przeprowadzono na myszach i szczurach, stosując doustne dawki cefaleksyny jednowodnej 0.6 i 1,5 razy większa od maksymalnej dawki dobowej dla człowieka (66 mg/kg/dobę) w zależności od powierzchni ciała i nie wykazały żadnych dowodów na upośledzenie płodności lub uszkodzenie płodu.
Karmiące matki
Cefaleksyna jest wydzielana do mleka ludzkiego. Należy zachować ostrożność w przypadku podawania cefaleksyny kobietom karmiącym.
Stosowanie u dzieci
Bezpieczeństwo i skuteczność stosowania cefaleksyny u pacjentów pediatrycznych ustalono w badaniach klinicznych dla dawek opisanych w punkcie dawkowanie i podawanie .
Stosowanie u osób w podeszłym wieku
Z 701 uczestników 3 opublikowanych badań klinicznych cefaleksyny, 433 (62%) miało 65 lat i więcej. Nie zaobserwowano ogólnych różnic w zakresie bezpieczeństwa i skuteczności pomiędzy tymi uczestnikami a młodszymi uczestnikami, a inne zgłoszone doświadczenia kliniczne nie wykazały różnic w reakcjach pomiędzy pacjentami w podeszłym wieku a młodszymi.
Ten lek jest w znacznym stopniu wydalany przez nerki, a ryzyko wystąpienia reakcji toksycznych na ten lek może być większe u pacjentów z zaburzoną czynnością nerek. Ponieważ u pacjentów w podeszłym wieku częściej występuje zmniejszona czynność nerek, należy zachować ostrożność w doborze dawki .
Niedobory czynności nerek
Cefaleksynę należy podawać ostrożnie w obecności zaburzonej czynności nerek (klirens kreatyniny < 30 mL/min, z dializą lub bez dializy). W takich warunkach należy prowadzić uważną obserwację kliniczną i monitorować czynność nerek w badaniach laboratoryjnych, ponieważ bezpieczna dawka może być mniejsza niż zwykle zalecana .
Przedawkowanie
Objawy przedawkowania doustnego mogą obejmować nudności, wymioty, dyskomfort w nadbrzuszu, biegunkę i krwiomocz. W przypadku przedawkowania należy zastosować ogólne środki podtrzymujące.
Wymuszona diureza, dializa otrzewnowa, hemodializa lub hemoperfuzja węglowa nie zostały uznane za korzystne w przypadku przedawkowania cefaleksyny.
Opis zawiesiny cefaleksyny
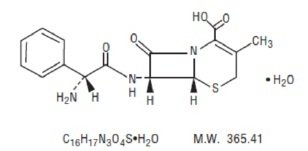
Cefaleksyna w postaci zawiesiny doustnej, USP jest półsyntetycznym lekiem przeciwbakteryjnym z grupy cefalosporyn przeznaczonym do podawania doustnego. Jest to monohydrat kwasu 7-(D-α-amino-α-fenyloacetamido)-3-metylo-3-cephem-4-karboksylowego. Cefaleksyna ma wzór cząsteczkowy C16H17N3O4S-H2O, a masa cząsteczkowa wynosi 365,41.
Cefaleksyna ma następujący wzór strukturalny:
Składniki nieaktywne: Koloidalny dwutlenek krzemu, FD&C Red # 40, metyloceluloza (15 premium LV), metyloceluloza (4AC premium), benzoesan sodu, aromat truskawkowy, sacharoza, guma ksantanowa.
Cefaleksyna zawiesina – farmakologia kliniczna
Mechanizm działania
Cefaleksyna jest cefalosporynowym lekiem przeciwbakteryjnym .
Farmakokinetyka
Wchłanianie:
Cefaleksyna jest stabilna kwasowo i może być podawana bez względu na posiłki. Po podaniu dawek 250 mg, 500 mg i 1 g, w ciągu 1 godziny uzyskano średnie szczytowe stężenia w surowicy wynoszące odpowiednio około 9, 18 i 32 mcg/ml. Stężenia w surowicy były wykrywalne po 6 godzinach od podania (na poziomie wykrywalności 0,2 mcg/mL).
Dystrybucja:
Cefaleksyna jest w około 10% do 15% związana z białkami osocza.
Wydalanie:
Cefaleksyna jest wydalana z moczem w procesie filtracji kłębuszkowej i wydzielania kanalikowego. Badania wykazały, że ponad 90% leku jest wydalane w postaci niezmienionej z moczem w ciągu 8 godzin. W tym okresie szczytowe stężenia w moczu po podaniu dawek 250 mg, 500 mg i 1 g wynosiły odpowiednio około 1 000, 2 200 i 5 000 mcg/ml.
Interakcje lekowe:
W grupie zdrowych osób, którym podano pojedyncze dawki 500 mg cefaleksyny i metforminy, średnie Cmax i AUC metforminy w osoczu zwiększyły się średnio odpowiednio o 34% i 24%, a średni klirens nerkowy metforminy zmniejszył się o 14%. Brak dostępnych informacji na temat interakcji cefaleksyny i metforminy po podaniu wielokrotnych dawek obu leków.
Mikrobiologia
Mechanizm działania
Cefaleksyna jest środkiem bakteriobójczym, który działa poprzez hamowanie syntezy ściany komórkowej bakterii.
Oporność
Gronkowce oporne na metycylinę i większość izolatów enterokoków są oporne na cefaleksynę. Cefaleksyna nie jest aktywna wobec większości izolatów Enterobacter spp., Morganella morganii i Proteus vulgaris. Cefaleksyna nie wykazuje aktywności wobec Pseudomonas spp. i Acinetobacter calcoaceticus. Penicylinooporny Streptococcus pneumoniae jest zwykle oporny krzyżowo na beta-laktamowe leki przeciwbakteryjne.
Działanie przeciwbakteryjne
Cefaleksyna wykazuje aktywność wobec większości izolatów następujących bakterii zarówno in vitro, jak i w zakażeniach klinicznych.
Bakterie gram-dodatnie
Staphylococcus aureus (tylko izolaty wrażliwe na metycylinę) Streptococcus pneumoniae (izolaty wrażliwe na penicylinę) Streptococcus pyogenes
Bakterie gram-Escherichia coli Haemophilus influenzae Klebsiella pneumoniae Moraxella catarrhalis Proteus mirabilis
Badanie wrażliwości
W celu uzyskania szczegółowych informacji dotyczących kryteriów interpretacji testu wrażliwości i związanych z nim metod badawczych oraz standardów kontroli jakości uznanych przez FDA dla tego leku, proszę zobaczyć: https://www.fda.gov/STIC.
Nonclinical Toxicology
Carcinogenesis & Mutagenesis & Impairment Of Fertility
Lifetime studies in animals have not been performed to evaluate the carcinogenic potential of cephalexin. Tests to determine the mutagenic potential of cephalexin have not been performed. In male and female rats, fertility and reproductive performance were not affected by cephalexin oral doses up to 1.5 times the highest recommended human dose based upon body surface area.
How Supplied/Storage and Handling
Cephalexin for oral suspension* USP (a strawberry flavored formula) is supplied as follows:
125 mg/5 mL:
Bottles of 100 mL (NDC 67877-544-88)
Bottles of 200 mL (NDC 67877-544-68)
250 mg/5 mL:
Bottles of 100 mL (NDC 67877-545-88)
Bottles of 200 mL (NDC 67877-545-68)
Directions for mixing are included on the label.
Przechowywać w temperaturze 20o do 25o C (68o do 77o F) .
Dobrze wstrząsnąć przed użyciem. Przechowywać szczelnie zamknięty.
*Po zmieszaniu przechowywać w lodówce. Może być przechowywany przez 14 dni bez znaczącej utraty mocy.
Informacje dla pacjenta
- Poradź pacjenta, że mogą wystąpić reakcje alergiczne, w tym poważne reakcje alergiczne, oraz że poważne reakcje wymagają natychmiastowego leczenia. Należy zapytać pacjenta o wszelkie wcześniejsze reakcje nadwrażliwości na cefaleksynę, inne beta-laktamy (w tym cefalosporyny) lub inne alergeny (5.1)
- Poradź pacjentom, że biegunka jest częstym problemem wywołanym przez leki przeciwbakteryjne i zwykle ustępuje po odstawieniu leku. Czasami może wystąpić częsta wodnista lub krwawa biegunka, która może być objawem poważniejszego zakażenia jelitowego. Jeśli wystąpi ciężka wodnista lub krwawa biegunka, należy poinformować pacjentów o konieczności skontaktowania się z lekarzem.
- Poradź pacjentom, że leki przeciwbakteryjne, w tym cefaleksyna, powinny być stosowane wyłącznie w leczeniu zakażeń bakteryjnych. Nie leczą one infekcji wirusowych (np. zwykłego przeziębienia). Kiedy cefaleksyna jest przepisywana w celu leczenia zakażenia bakteryjnego, należy powiedzieć pacjentom, że chociaż często zdarza się, że czują się lepiej na początku leczenia, lek należy przyjmować dokładnie według zaleceń. Pominięcie dawek lub nieukończenie pełnego kursu terapii może (1) zmniejszyć skuteczność natychmiastowego leczenia i (2) zwiększyć prawdopodobieństwo, że bakterie rozwiną oporność i nie będą mogły być leczone cefaleksyną lub innymi lekami przeciwbakteryjnymi w przyszłości.
Manufactured in India by:
Alkem Laboratories Ltd.,
Mumbai – 400013, INDIA.
Dystrybuowane przez:
Ascend Laboratories, LLC
Parsippany, NJ 07054
Revised: December, 2018
PT 2851
PACKAGE LABEL.PRINCIPAL DISPLAY PANEL
NDC 67877-544-88
Cephalexin for Oral Suspension, USP 125 mg per 5 mL
w przypadku rekonstytucji zgodnie z zaleceniami.
Usual Pediatric Dose: 25 do 50 mg na kg na dobę w czterech dawkach podzielonych. W przypadku cięższych zakażeń dawka może być podwojona. Patrz literatura towarzysząca.
Rx only
For Oral use only
100 mL (po zmieszaniu)
Ascend Laboratories, LLC

NDC 67877-545-88
Cephalexin for Oral Suspension, USP 250 mg na 5 mL
po przygotowaniu zgodnie z zaleceniami.wykła dawka pediatryczna: 25 do 50 mg na kg na dobę w czterech dawkach podzielonych. W przypadku cięższego zakażenia dawka może być podwojona.
Zobacz literaturę towarzyszącą.
Tylko na receptę
Do stosowania doustnego
100 ml (po zmieszaniu)
Ascend Laboratories, LLC

| CEPHALEXIN cefaleksyna do sporządzania zawiesiny |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| CEPHALEXIN cephalexin for suspension |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Ascend Laboratories, LLC (141250469)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Alkem Laboratories Limited | 915628612 | MANUFACTURE(67877-544, 67877-545) | |
Frequently asked questions
- What are the best antibiotics for a tooth infection?
- Cephalexin – can this be used to treat an abscess in the mouth or gum infection?
- If people are allergic to amoxicillin can they take cephalexin?
- What is the best antibiotic to treat strep throat?
- Can you take cephalexin for a spider bite?
- Can you take antibiotics while pregnant?
- Cephalexin – is this a drug that can be abused by teens?
More about cephalexin
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Patient Tips
- Drug Images
- Drug Interactions
- Compare Alternatives
- Support Group
- Pricing & Coupons
- En Español
- 415 Reviews
- Drug class: first generation cephalosporins
Consumer resources
- Patient Information
- Cephalexin (Advanced Reading)
Professional resources
- Prescribing Information
- Cephalexin (Professional Patient Advice)
- Cephalexin (FDA)
- Cephalexin Tablets (FDA)
Other brands Keflex, Daxbia, Panixine
Related treatment guides
- Bacterial Infection
- Bladder Infection
- Bacterial Endocarditis Prevention
- Acne
- … +7 more
Medical Disclaimer