Obliczanie Stopni Nienasycenia (DoU)
Stopień Nienasycenia (DoU) jest również znany jako Równoważnik Wiązania Podwójnego. Jeśli podany jest wzór cząsteczkowy, wpisz liczby do tego wzoru:
- (C) to liczba węgli
- (N) to liczba nitrogenów
- (X) to liczba chlorowców (F, Cl, Br, I)
- (H) to liczba hydrogenów
Jak stwierdzono wcześniej, nasycona cząsteczka zawiera tylko pojedyncze wiązania i nie zawiera pierścieni. Innym sposobem interpretacji tego jest to, że nasycona cząsteczka ma maksymalną liczbę atomów wodoru możliwą do bycia acyklicznym alkanem. Tak więc, liczba hydrogenów może być reprezentowana przez 2C+2, co jest ogólną molekularną reprezentacją alkanu. Na przykład, dla wzoru molekularnego C3H4 liczba rzeczywistych hydrogenów potrzebnych do tego, aby związek był nasycony wynosi 8 . Aby związek był w pełni nasycony potrzebuje jeszcze 4 hydrogeny (oczekiwana liczba hydrogenów-obserwowana liczba hydrogenów=8-4=4). Stopień nienasycenia jest równy 2, czyli połowie liczby hydrogenów, których potrzebuje cząsteczka, aby zostać zaklasyfikowana jako nasycona. Stąd wzór DoB dzieli przez 2. Wzór odejmuje liczbę X, ponieważ halogen (X) zastępuje wodór w związku. Na przykład, w chloroetanie, C2H5Cl, jest o jeden wodór mniej w porównaniu z etanem, C2H6.
Aby związek był nasycony, w cząsteczce jest o jeden wodór więcej, gdy jest w niej obecny azot. Dlatego dodajemy liczbę nitrogenów (N). Można to zaobserwować w przypadku C3H9N w porównaniu do C3H8. Tlen i siarka nie są uwzględnione we wzorze, ponieważ te elementy nie mają wpływu na nasycenie. As seen in alcohols, the same number of hydrogens in ethanol, C2H5OH, matches the number of hydrogens in ethane, C2H6.
The following chart illustrates the possible combinations of the number of double bond(s), triple bond(s), and/or ring(s) for a given degree of unsaturation. Each row corresponds to a different combination.
- One degree of unsaturation is equivalent to 1 ring or 1 double bond (1 \( \pi \) bond).
- Two degrees of unsaturation is equivalent to 2 double bonds, 1 ring and 1 double bond, 2 rings, or 1 triple bond (2 \( \pi \) bonds).
|
DoU
|
Possible combinations of rings/ bonds
|
||
|---|---|---|---|
|
|
# of rings
|
# of double bonds
|
# of triple bonds
|
|
1
|
1
|
0
|
0
|
|
|
0
|
1
|
0
|
|
2
|
2
|
0
|
0
|
|
|
0
|
2
|
0
|
|
|
0
|
0
|
1
|
|
|
1
|
1
|
0
|
| 3 | 3 | 0 | 0 |
| 2 | 1 | 0 | |
| 1 | 2 | 0 | |
| 0 | 1 | 1 | |
| 0 | 3 | 0 | |
| 1 | 0 | 1 | |
Remember, stopnie nienasycenia dają tylko sumę wiązań podwójnych, wiązań potrójnych i/lub pierścieni. Na przykład, stopień nienasycenia równy 3 może zawierać 3 pierścienie, 2 pierścienie+1 wiązanie podwójne, 1 pierścień+2 wiązania podwójne, 1 pierścień+1 wiązanie potrójne, 1 wiązanie podwójne+1 wiązanie potrójne lub 3 wiązania podwójne.
Przykład: Benzen
Jaki jest stopień nienasycenia dla benzenu?
ROZWIĄZANIE
Wzór cząsteczkowy benzenu to C6H6. Zatem,
DoU= 4, gdzie C=6, N=0,X=0, i H=6. 1 DoB może równać się 1 pierścieniowi lub 1 wiązaniu podwójnemu. Odpowiada to benzenowi zawierającemu 1 pierścień i 3 wiązania podwójne.
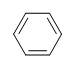
H Jednakże, gdy podamy wzór cząsteczkowy C6H6, benzen jest tylko jedną z wielu możliwych struktur (izomerów). Następujące struktury wszystkie mają DoB równe 4 i mają ten sam wzór cząsteczkowy co benzen.