Wprowadzenie
Wiązanie jonowe to całkowite przeniesienie elektronu(ów) walencyjnego(ych) pomiędzy atomami. Jest to rodzaj wiązania chemicznego, które generuje dwa przeciwnie naładowane jony. W wiązaniach jonowych metal traci elektrony, aby stać się dodatnio naładowanym kationem, podczas gdy niemetal przyjmuje te elektrony, aby stać się ujemnie naładowanym anionem. Wiązania jonowe wymagają donora elektronów, często metalu, i akceptora elektronów, niemetalu.
Wiązanie jonowe jest obserwowane, ponieważ metale mają niewiele elektronów na swoich najbardziej zewnętrznych orbitalach. Tracąc te elektrony, metale te mogą osiągnąć konfigurację gazu szlachetnego i spełnić regułę oktetu. Podobnie, niemetale, które mają blisko do 8 elektronów w ich powłoki walencyjne mają tendencję do łatwo przyjąć elektrony, aby osiągnąć konfigurację gazu szlachetnego. W wiązaniu jonowym, więcej niż 1 elektron może być oddany lub przyjęty, aby spełnić regułę oktetu. Ładunki na anionie i kationie odpowiadają liczbie oddanych lub otrzymanych elektronów. W wiązaniach jonowych, ładunek netto związku musi wynosić zero.
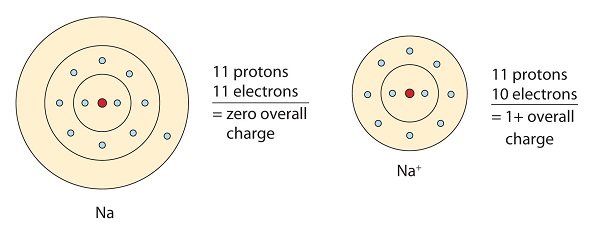
Ta cząsteczka sodu oddaje samotny elektron w swoim orbitalu walencyjnym, aby osiągnąć konfigurację oktetu. To tworzy dodatnio naładowany kation z powodu utraty elektronu.
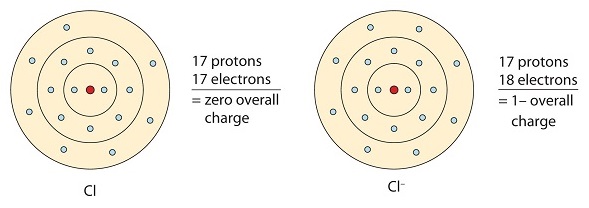
Ten atom chloru otrzymuje jeden elektron, aby osiągnąć konfigurację oktetu, co tworzy ujemnie naładowany anion.
Przewidywana całkowita energia procesu wiązania jonowego, która obejmuje energię jonizacji metalu i powinowactwo elektronowe niemetalu, jest zazwyczaj dodatnia, co wskazuje, że reakcja jest endotermiczna i niekorzystna. Jednakże, reakcja ta jest wysoce korzystna z powodu przyciągania elektrostatycznego pomiędzy cząsteczkami. Przy idealnej odległości międzyatomowej, przyciąganie pomiędzy tymi cząsteczkami uwalnia wystarczającą ilość energii, aby ułatwić reakcję. Większość związków jonowych ma tendencję do dysocjacji w polarnych rozpuszczalnikach, ponieważ są one często polarne. Zjawisko to jest spowodowane przeciwnymi ładunkami na każdym jonie.
Przykład: Sole chlorkowe
.jpg?revision=2)
W tym przykładzie atom sodu oddaje swój 1 elektron walencyjny atomowi chloru. W ten sposób powstaje kation sodu i anion chloru. Zauważ, że ładunek netto powstałego związku wynosi 0.
.jpg?revision=2)
W tym przykładzie atom magnezu oddaje oba swoje elektrony walencyjne atomom chloru. Każdy atom chloru może przyjąć tylko 1 elektron zanim osiągnie konfigurację gazu szlachetnego; dlatego 2 atomy chloru są wymagane do przyjęcia 2 elektronów przekazanych przez magnez. Notice that the net charge of the compound is 0.