Knut Eichhorn-Mulligan, MD, PhD e Ivana K. Kim, MD, Boston
Nevos coroidais, especialmente os pequenos, são comuns. As estimativas de sua prevalência variam de 5 a 10 por cento da população geral. O Blue Mountains Eye Study registrou nevos coroidais em 6,5% de uma população estudada prospectivamente de australianos brancos de meia idade.1 Os melanomas coroidais, por outro lado, são felizmente uma entidade rara, com uma incidência estimada de aproximadamente seis por milhão. No entanto, o melanoma coróide é a malignidade intra-ocular primária mais comum em adultos, e o diagnóstico imediato e preciso é importante.
br>Características de Nevi
br>Histologicamente, os nevos são neoplasias benignas dos melanócitos que residem nas camadas externas do coróide. Eles aparecem tipicamente como uma lesão plana, cinza ardósia sob a retina. No entanto, os nevos podem ser completamente não pigmentados em até 10% dos casos.2 Estima-se que o risco de transformação maligna seja bastante baixo.3 No entanto, os nevos têm o potencial de causar disfunção visual, especialmente se estiverem localizados perto da fóvea. Ao comprimir a coriocapilaridade sobreposta, os nevos mais espessos podem obstruir o fluxo sanguíneo para as camadas retinianas externas e levar à EPR e à degeneração fotoreceptor.4 Os nevos têm sido associados a defeitos de campo visual em um número surpreendentemente grande de pacientes, embora, se periféricos, esses déficits possam não se tornar sintomáticos.5,6 Complicações visualmente mais significativas que têm sido observadas em associação aos nevos benignos incluem descolamentos serosos da EPR e da retina e neovascularização coróide.4 Uma revisão recente da função visual em mais de 3.400 pacientes com nevos no Wills Eye Hospital mostrou que o risco estimado de perda da visão em 15 anos foi de 2% em pacientes com nevos extrafoveolares, mas de 26% em pacientes com nevos subfoveolares.7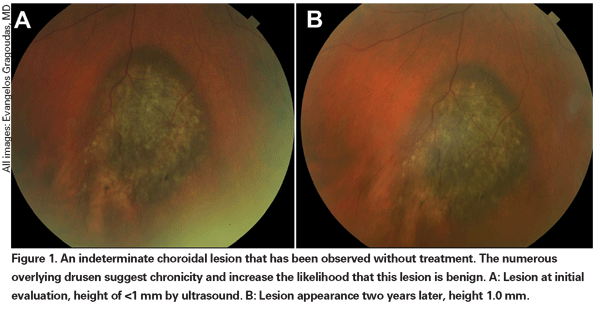
br> Se os melanomas surgem de nevos pré-existentes, ou são de fato uma entidade separada, é algo controverso. A análise dos olhos enucleados tem demonstrado características histológicas características dos nevos dentro das bordas dos melanomas malignos, sugerindo que pelo menos alguns melanomas podem evoluir de transformação maligna dentro dos nevos pré-existentes.8 Entretanto, o risco de que um nevo coróide possa se transformar em um melanoma é geralmente considerado extremamente baixo. As estimativas das taxas anuais de transformação maligna variam de uma em 4.800 a uma em 8.800,3,9
Em geral, pequenos nevos coroidais raramente se expandem. No estudo da Blue Mountains, dos 160 nevos (diâmetro médio de 1,25 mm), para os quais havia pelo menos cinco anos de seguimento, apenas um mostrou um ligeiro aumento no diâmetro.10 No entanto, há vários relatos de nevos coroidais confirmados histologicamente que tinham mostrado aumento progressivo, mas que não apresentavam quaisquer características malignas numa revisão cuidadosa.11,12 Além disso, em uma análise de mais de 2.500 olhos seguidos em uma prática de referência terciária, Carol Shields, MD, e colegas notaram aumento em 3 a 4% dos nevos sem características de transformação maligna.2 Os nevos nesta coorte baseada na clínica eram significativamente maiores na linha de base do que os do estudo baseado na população Blue Mountains, com uma média de aproximadamente 5 mm de diâmetro.
 br>Detecting Small Melanomas
br>Detecting Small Melanomas
br> Lesões coroidais pigmentadas que estão levemente elevadas podem ser chamadas lesões indeterminadas e apresentar um desafio no que diz respeito ao diagnóstico e ao manejo. Dados os riscos e limitações com relação à obtenção de confirmação histológica da malignidade, os oftalmologistas precisam confiar nas características clínicas identificadas como preditivas de crescimento e metástase para diferenciar pequenos melanomas de tumores melanocíticos coroidais elevados que são provavelmente benignos. Dr. Shields e colegas identificaram cinco fatores associados ao risco de crescimento de pequenas lesões melanocíticas coroidais com menos de 3 mm de espessura, a partir de análises retrospectivas de aproximadamente 1.300 pacientes.13 Esses fatores foram 1) espessura do tumor maior que 2,0 mm; 2) fluido subretinal; 3) sintomas visuais; 4) pigmento laranja; 5) margem tumoral posterior tocando o disco. O crescimento da lesão foi observado em 4% dos pacientes com nenhum desses fatores de risco, 36% dos pacientes com um fator de risco e em mais de 50% dos pacientes com três ou mais fatores.14 Fatores clínicos associados a um aumento do risco de metástase foram incluídos: 1) margem posterior tocando o disco; 2) crescimento documentado; e 3) aumento da espessura do tumor (maior/igual a 1,1 mm).13 O estudo observacional de pequeno tumor realizado pelo grupo do Collaborative Ocular Melanoma Study (COMS) identificou fatores de risco similares associados ao crescimento tumoral; a saber: 1) maior espessura apical do tumor, 2) maior diâmetro basal inicial, 3) presença de pigmento laranja, 4) ausência de drusen, e 5) ausência de alteração epitelial do pigmento retiniano adjacente ao tumor.15 Estes dois últimos fatores confirmam a observação clínica de que a presença de drusen e alterações de pigmento são indicadores de cronicidade e, portanto, são mais propensos a serem vistos sobre lesões dormente e benignas. 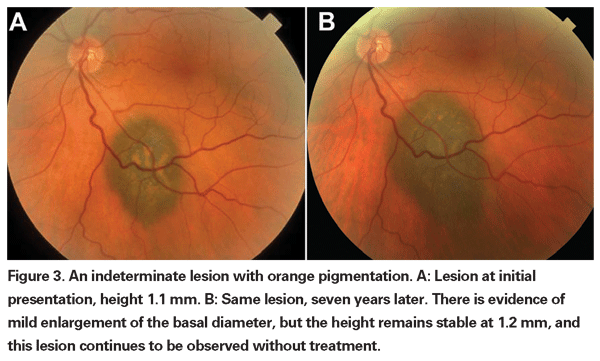
br>As características de pigmentação também podem ser úteis na avaliação do potencial de malignidade. A presença de uma zona calma interna na ultra-sonografia de varredura B e pontos quentes na angiografia fluorescente tem se mostrado como preditores de crescimento tumoral.16 O papel da tomografia de coerência óptica na avaliação de lesões coroidais também está sendo explorado. Gabriella Espinoza, MD e colegas propuseram que a TCO pode ser valiosa na diferenciação entre fluido subretinal ativo, onde a retina sobreposta à lesão é elevada, mas de outra forma normal na aparência, e mudanças crônicas como afinamento da retina ou cistos intraretinosos. Em suas pequenas séries, eles encontraram uma correlação entre um fluido subretínico ativo na TOC e o crescimento tumoral documentado.17
br> Tratamento precoce vs. Observação
br> Quando a enucleação era a única forma de tratamento aceita para o melanoma, a observação até o crescimento documentado foi defendida para pequenos tumores que não puderam ser definitivamente diagnosticados como melanomas na apresentação inicial. Agora, com a disponibilidade e eficácia demonstrada das terapias com glóbulos brancos, pode-se argumentar a favor de um tratamento mais precoce destas lesões indeterminadas. Os dados dos ensaios COMS revelam que a mortalidade relacionada aos melanomas varia com o tamanho do tumor no momento do tratamento. Para tumores médios (definidos como tumores de 2,5 a 10 mm em altura apical e até 16 mm no maior diâmetro basal), a mortalidade específica da melanoma foi de 10% aos cinco anos e de 18% aos 10 anos.18 Para tumores grandes (aqueles que excedem o critério de tamanho para tumores médios em altura apical ou maior diâmetro basal; ou tumores peripapilares com altura apical maior que 8 mm), as taxas aumentaram para aproximadamente 27% aos cinco anos e 40% aos 10 anos.19 Além disso, como mencionado acima, o crescimento documentado antes do tratamento demonstrou ser um fator de risco para metástase. Entretanto, o crescimento pode ser um marcador para tumores mais agressivos e não foi comprovado que o tratamento precoce destes tumores reduza a mortalidade.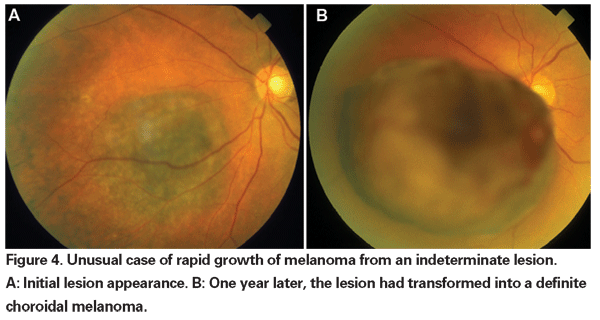
Nossos métodos atuais de radioterapia permitem o controle efetivo do tumor local com conservação do globo terrestre, mas a morbidade visual ainda é alta. Portanto, é necessário pesar o risco de mortalidade incorrido pela observação cuidadosa antes do tratamento de lesões indeterminadas contra as conseqüências da perda visual induzida pela terapia. No estudo observacional de pequeno tumor COMS, houve seis mortes relacionadas à melanoma em um grupo de 67 pacientes com tumores que foram tratados após um período inicial de observação.20 Apenas duas dessas mortes ocorreram dentro de cinco anos após a inscrição, resultando em uma taxa de mortalidade específica por melanoma de aproximadamente 3% em cinco anos. Mais recentemente, investigadores do Bascom Palmer Eye Institute relataram uma taxa de mortalidade específica por melanoma de 3,9% em cinco anos em um pequeno grupo de pacientes com suspeita de melanoma coróide observado para crescimento ou desenvolvimento de pigmento laranja antes do tratamento com radioterapia com placa.21 Esses estudos sugerem baixas taxas de mortalidade associadas ao tratamento tardio de lesões indeterminadas. Além disso, uma pequena série retrospectiva não mostrou aumento na mortalidade específica do melanoma entre pacientes prontamente tratados e pacientes inicialmente observados.22 Até o momento, não há evidências que demonstrem um benefício de sobrevida do tratamento precoce versus tardio de pequenos tumores que não possam ser definitivamente diagnosticados como melanomas. Portanto, não está claro que sacrificar a visão em um maior número de pacientes com lesões indeterminadas definitivamente salvará mais vidas.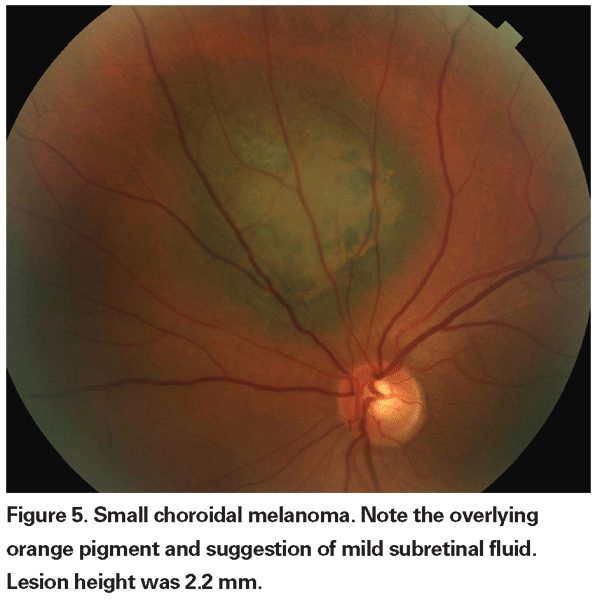 br>>/p>
br>>/p>
>br> Para resumir, as lesões pigmentadas coroidais podem ser agrupadas em três categorias: 1) lesões pequenas e planas que são claramente nevos coroidais; 2) lesões pequenas com elevação <2,5 mm que podem ter pigmento laranja ou fluido subretinal ou um dos outros fatores que levantam suspeita de malignidade – as chamadas lesões indeterminadas; e 3) tumores coroidais em forma de cúpula ou cogumelo maiores que/igual a 2,5 mm que são claramente melanomas. É o tratamento das lesões indeterminadas que ainda permanece uma área de controvérsia, e a avaliação e o manejo dessas lesões é melhor realizado pelos oncologistas oculares. Um ensaio clínico comparando tratamento precoce vs. tratamento tardio para lesões indeterminadas pode não ser viável devido ao grande número de pacientes e ao tempo de seguimento necessário para resultados conclusivos. Com os avanços contínuos nas técnicas de diagnóstico molecular, a melhor esperança para aumentar a sobrevivência de pacientes com melanoma coróide está no desenvolvimento de tratamentos eficazes para a doença metastática e na busca de biomarcadores que possam prever com mais precisão a transformação maligna.
>br>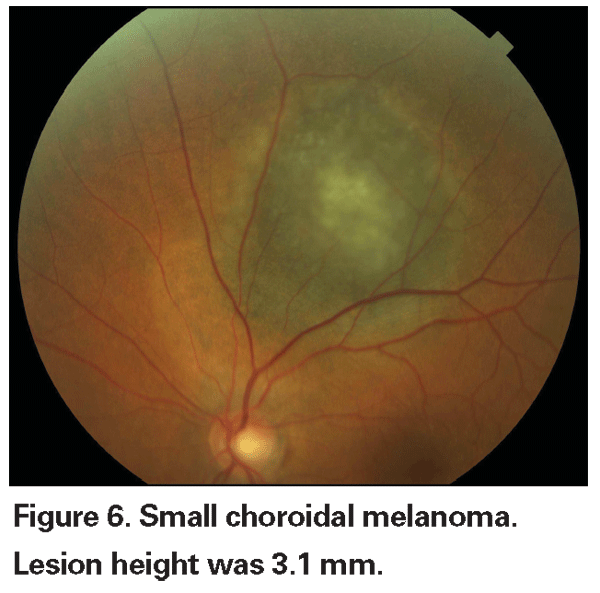
br> Dr. Eichhorn-Mulligan está em residência em oftalmologia na Harvard Medical School. Dr. Kim é professor assistente no Departamento de Oftalmologia na Harvard Medical School, Retina Service, Massachusetts Eye and Ear Infirmary.
1. Sumich P, Mitchell P, Wang J. Choroidal nevi em uma população branca – o Estudo dos Olhos das Montanhas Azuis. Arch of Ophthalmol 1998;116: 645-650.
2. Shields CL, Furuta M, Mashayekhi A, Berman EL, Zahler JD, Hoberman DM, Dinh DH, Shields JA. Espectro clínico de nevos coróides baseado na idade de apresentação em 3.422 olhos consecutivos. Oftalmologia 2007: Dez 5 .
3. Singh AD, Kalyani P, Topham A. Estimando o risco de transformação maligna de um nevus coróide. Ophthalmology 2005;112: 1784-1789.
4. Gonder JR, Augsburger JJ, McCarthy EF, Shields JA. Perda visual associada a nevos coroidais. Ophthalmology 1982;89:961-965.
5. Tamler E, Maumenee AE. Estudo clínico dos nevos coroidais. Arch Ophthalmol 1959;62:196-202.
6. Flindall RJ, Drance SM. Estudos de campo visual de melanomas coroidais benignos. Arch Ophthalmol 1969;81:41-44.
7. Shields CL, Furuta M, Mashayekhi A, Berman EL, Zahler JD, Hoberman DM, Dinh DH, Shields JA. Acuidade visual em 3.422 olhos consecutivos com nevus choroidais. Arch Ophthalmol 2007;125:1501-1507.
8. Yanoff M, Zimmerman LE. Histogénese dos melanomas malignos da uvea. II. Relação dos nevos uveais com melanomas malignos. Câncer 1967;20:493-507.
9. Ganley JP, Comstock GW. Benignos nevos e melanomas malignos do coróide. Am J Ophthalmol 1973;76:19-25.
10. Thiagalingam S, Wang JJ, Mitchell P. Ausência de mudança nos nevos coróides ao longo de 5 anos em uma população mais velha. Arch Ophthalmol 2004;122:89-93.
11. MacIlwaine WA, Anderson B Jr, Klintworth GK. Ampliação de um nevus coróide histologicamente documentado. Am J Ophthalmol 1979;87:480-486.
12. Elner VM, Flint A, Vine AK. Histopatologia do crescimento documentado em pequenos tumores coróides melanocíticos. Arch Ophthalmol 2004;122:1876-1878.
13. Shields CL, Shields JA, Kiratli H, De Potter P, Cater JR. Fatores de risco para crescimento e metástase de pequenas lesões melanocíticas coroidais. Ophthalmology 1995;102:1351-1361.
14. Shields CL, Cater J, Shields JA, Singh AD, Santos MCM, Carvalho C. Combinação de fatores clínicos preditivos do crescimento de pequenos tumores melanocíticos coroidais. Arch Ophthalmol 2000;118:360-364.
15. O Grupo de Estudo do Melanoma Ocular Colaborativo. Fatores preditivos do crescimento e tratamento de pequenos melanomas coroidais. Arch Ophthalmol 1997;115:1537-1544.
16. Butler P, Char DH, Zarbin M, Kroll S. História natural de tumores coroidais pigmentados indeterminados. Oftalmologia 1994;101: 710-716.
17. Espinoza G, Rosenblatt B, Harbour W. Tomografia de coerência óptica na avaliação das alterações da retina associadas a tumores coroidais melanocíticos suspeitos. Am J Ophthalmol 2004;137:90-95.
18. O Grupo de Estudo do Melanoma Ocular Colaborativo. O ensaio randomizado COMS de braquiterapia com iodo 125 para o melanoma coróide: V. Taxas de mortalidade de 12 anos e fatores prognósticos: Relatório COMS No. 28. Arch Ophthalmol 2006;1684-1693.
19. Hawkins BS, O Grupo de Estudo do Melanoma Ocular Colaborativo. The Collaborative Ocular Melanoma Study (COMS), The Collaborative Ocular Melanoma Study (COMS), estudo randomizado da radiação pré-enucleação de melanoma coróide de grande porte: IV. Achados de mortalidade em dez anos e fatores prognósticos. Relatório COMS no. 24. Am J Ophthalmol 2004;138:936-951.
20. The Collaborative Ocular Melanoma Study Group. Mortalidade em pacientes com melanoma coróide de pequeno porte. Arch of Ophthalmol 1997;115:886-893.
21. Sobrin L, Schiffman JC, Markoe AM, Murray TG. Resultados da radioterapia com placa de iodo 125 após observação inicial de suspeita de pequenos melanomas coroidais. Ophthalmology 2005;112:1777-1783.
22. Augsburger JJ, Vrabec TR. Impact of delayed treatment in growing posterior uveal melanomas. Arch Ophthalmol 1993;111:1382-6.