Knut Eichhorn-Mulligan, MD, PhD e Ivana K. Kim, MD, Boston
I nevi coroidei, specialmente quelli piccoli, sono comuni. Le stime della loro prevalenza vanno dal 5 al 10% della popolazione generale. Il Blue Mountains Eye Study ha registrato nevi coroideali nel 6,5% di una popolazione studiata prospetticamente di australiani bianchi per lo più di mezza età.1 I melanomi coroideali, d’altra parte, sono fortunatamente un’entità rara, con un’incidenza stimata di circa sei per milione. Ciononostante, il melanoma coroidale è il tumore maligno intraoculare primario più comune negli adulti e una diagnosi rapida e accurata è importante.
Caratteristiche dei nevi
I nevi sono neoplasie benigne dei melanociti che risiedono negli strati esterni della coroide. Appaiono tipicamente come una lesione piatta, grigio ardesia, sotto la retina. Tuttavia, i nevi possono essere completamente non pigmentati fino al 10% dei casi.2 Il rischio di trasformazione maligna è stimato essere piuttosto basso.3 Tuttavia, i nevi hanno il potenziale di causare disfunzioni visive, specialmente se si trovano vicino alla fovea. Comprimendo la coriocapillare sovrastante, i nevi più spessi possono ostruire il flusso di sangue all’RPE e agli strati retinici esterni e portare alla degenerazione dell’RPE e dei fotorecettori.4 I nevi sono stati associati a difetti del campo visivo in un numero sorprendentemente grande di pazienti, anche se, se periferici, questi deficit possono non diventare sintomatici.5,6 Complicazioni visivamente più significative che sono state osservate in associazione con nevi benigni includono distacchi sierosi dell’RPE e della retina e neovascolarizzazione coroideale.4 Una recente revisione della funzione visiva in più di 3.400 pazienti con nevi al Wills Eye Hospital ha mostrato che il rischio stimato di perdita della vista in 15 anni era del 2% nei pazienti con nevi extrafoveali, ma del 26% nei pazienti con nevi subfoveolari.7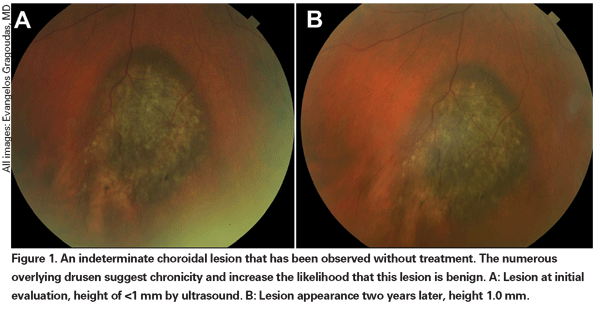
Se i melanomi nascano da nevi preesistenti, o siano in realtà un’entità separata, è alquanto controverso. L’analisi di occhi enucleati ha dimostrato caratteristiche istologiche caratteristiche dei nevi all’interno dei bordi dei melanomi maligni, suggerendo che almeno alcuni melanomi possono evolvere dalla trasformazione maligna all’interno di nevi preesistenti.8 Tuttavia, il rischio che un nevo coroideale possa trasformarsi in un melanoma è generalmente considerato estremamente basso. Le stime dei tassi annuali di trasformazione maligna variano da uno su 4.800 a uno su 8.800.3,9
In generale, i piccoli nevi coroideali si ingrandiscono raramente. Nello studio Blue Mountains, su 160 nevi (diametro medio 1,25 mm), per i quali erano disponibili almeno cinque anni di follow-up, solo uno ha mostrato un leggero aumento di diametro.10 Tuttavia, ci sono diversi rapporti di nevi coroideali confermati istologicamente che avevano mostrato un progressivo ingrandimento, ma mancavano di caratteristiche maligne ad un esame attento.11,12 Inoltre, in un’analisi di più di 2.500 occhi seguiti in uno studio di riferimento terziario, Carol Shields, MD, e colleghi hanno notato un ingrandimento nel 3-4% dei nevi senza caratteristiche di trasformazione maligna.2 I nevi in questa coorte basata sulla clinica erano significativamente più grandi al basale di quelli nello studio Blue Mountains basato sulla popolazione, con una media di circa 5 mm di diametro.

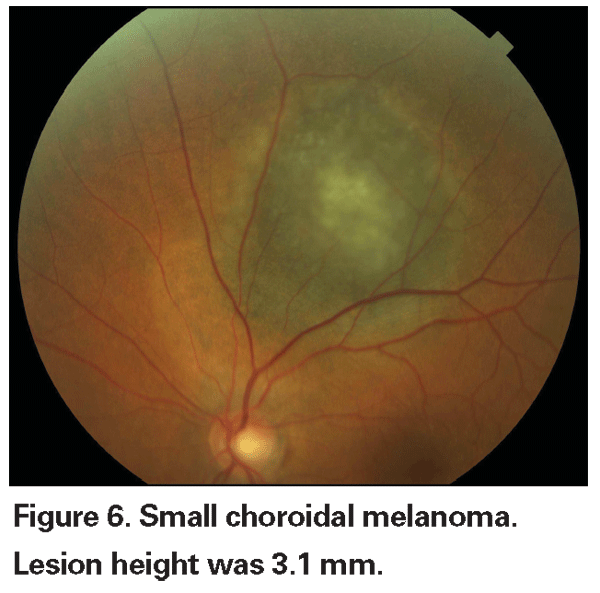
Rilevamento di piccoli melanomi
Le lesioni coroideali pigmentate che sono lievemente elevate possono essere chiamate lesioni indeterminate e rappresentano una sfida per quanto riguarda la diagnosi e la gestione. Dati i rischi e le limitazioni rispetto all’ottenimento della conferma istologica della malignità, gli oftalmologi devono fare affidamento sulle caratteristiche cliniche identificate come predittive di crescita e metastasi per differenziare i piccoli melanomi dai tumori melanocitici coroideali elevati che sono probabilmente benigni. Il Dr. Shields e colleghi hanno identificato cinque fattori associati al rischio di crescita di piccole lesioni melanocitiche coroideali di spessore inferiore a 3 mm da analisi retrospettive di circa 1.300 pazienti.13 Questi fattori sono 1) spessore del tumore superiore a 2,0 mm; 2) liquido sottoretinico; 3) sintomi visivi; 4) pigmento arancione; 5) margine posteriore del tumore che tocca il disco. La crescita della lesione è stata osservata nel 4% dei pazienti con nessuno di questi fattori di rischio, nel 36% di quelli con un fattore di rischio e in più del 50% di quelli con tre o più fattori.14 I fattori clinici associati a un aumento del rischio di metastasi includevano: 1) margine posteriore che tocca il disco; 2) crescita documentata; e 3) aumento dello spessore del tumore (maggiore/uguale a 1,1 mm).13 Lo studio osservazionale sui piccoli tumori condotto dal Collaborative Ocular Melanoma Study (COMS) Group ha identificato fattori di rischio simili associati alla crescita del tumore, ovvero 1) maggiore spessore apicale del tumore, 2) maggiore diametro basale iniziale, 3) presenza di pigmento arancione, 4) assenza di drusen, e 5) assenza di cambiamenti dell’epitelio retinico adiacente al tumore.15 Questi ultimi due fattori confermano l’osservazione clinica che la presenza di drusen e di alterazioni del pigmento sono indicatori di cronicità, e quindi hanno più probabilità di essere visti su lesioni dormienti e benigne. 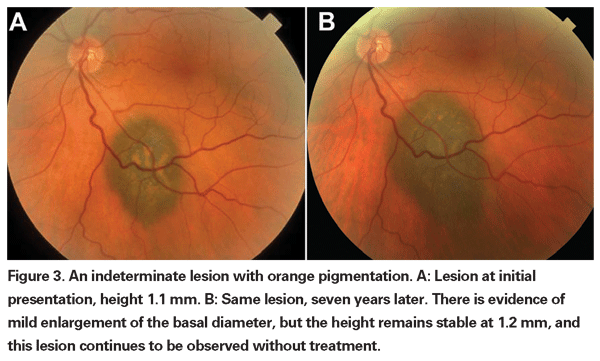
Le caratteristiche di imaging possono anche essere utili per valutare il potenziale di malignità. La presenza di una zona di quiete interna sull’ultrasonografia B-scan e di punti caldi sull’angiografia con fluoresceina hanno dimostrato di essere predittori della crescita tumorale.16 Il ruolo della tomografia a coerenza ottica nella valutazione delle lesioni coroideali è anch’esso allo studio. Gabriella Espinoza, MD, e colleghi hanno proposto che l’OCT può essere prezioso nel differenziare tra il fluido sottoretinico attivo, in cui la retina sovrastante la lesione è elevata ma altrimenti di aspetto normale, e i cambiamenti cronici come l’assottigliamento retinico o le cisti intraretiniche. Nella loro piccola serie, hanno trovato una correlazione tra un fluido subretinico attivo sull’OCT e la crescita documentata del tumore.17
Trattamento precoce vs. Osservazione
Quando l’enucleazione era l’unica forma accettata di trattamento per il melanoma, l’osservazione fino alla crescita documentata era raccomandata per i piccoli tumori che non potevano essere definitivamente diagnosticati come melanomi alla presentazione iniziale. Ora, con la disponibilità e l’efficacia dimostrata di terapie che risparmiano il globo, si può parlare di un trattamento anticipato di queste lesioni indeterminate. I dati degli studi COMS rivelano che la mortalità legata al melanoma varia con le dimensioni del tumore al momento del trattamento. Per i tumori medi (definiti come tumori da 2,5 a 10 mm di altezza apicale e fino a 16 mm di diametro basale maggiore), la mortalità specifica per il melanoma era del 10% a cinque anni e del 18% a 10 anni.18 Per i tumori di grandi dimensioni (quelli che superano i criteri di dimensione dei tumori medi sia in altezza apicale che nel diametro basale maggiore; o i tumori peripapillari con un’altezza apicale maggiore di 8 mm), i tassi sono aumentati fino a circa il 27% a cinque anni e il 40% a 10 anni.19 Inoltre, come già detto, la crescita documentata prima del trattamento ha dimostrato di essere un fattore di rischio per le metastasi. Tuttavia, la crescita può essere un marcatore di tumori più aggressivi, e non è stato dimostrato che trattare questi tumori prima riduca la mortalità.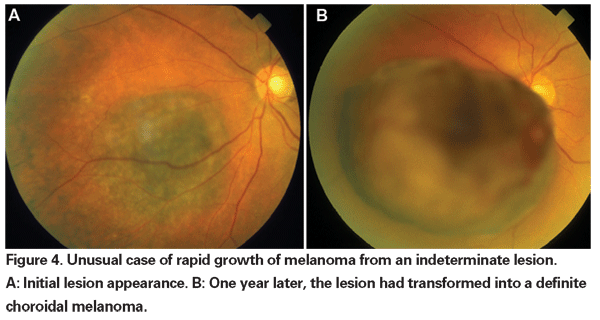
I nostri attuali metodi di radioterapia permettono un efficace controllo locale del tumore con conservazione del globo, ma la morbilità visiva è ancora alta. Pertanto, è necessario soppesare il rischio di mortalità sostenuto da un’attenta osservazione prima del trattamento delle lesioni indeterminate rispetto alle conseguenze della perdita visiva indotta dalla terapia. Nello studio osservazionale COMS sui piccoli tumori, ci sono stati sei decessi legati al melanoma su un gruppo di 67 pazienti con tumori che sono stati trattati dopo un periodo iniziale di osservazione.20 Solo due di questi decessi si sono verificati entro cinque anni dall’arruolamento, risultando in un tasso di mortalità specifico del melanoma a cinque anni del 3% circa. Più recentemente, i ricercatori del Bascom Palmer Eye Institute hanno riportato un tasso di mortalità a cinque anni specifico per il melanoma del 3,9% in un piccolo gruppo di pazienti con sospetto melanoma coroideale osservati per la crescita o lo sviluppo di pigmento arancione prima del trattamento con radioterapia a placche.21 Questi studi suggeriscono bassi tassi di mortalità associati al trattamento ritardato per lesioni indeterminate. Inoltre, una piccola serie retrospettiva non ha mostrato alcun aumento della mortalità specifica per il melanoma tra i pazienti trattati tempestivamente e quelli osservati inizialmente.22 Ad oggi, non ci sono prove che dimostrino un beneficio di sopravvivenza dal trattamento anticipato rispetto a quello ritardato di piccoli tumori che non possono essere definitivamente diagnosticati come melanomi. Pertanto, non è chiaro che sacrificare la vista in un maggior numero di pazienti con lesioni indeterminate salverà sicuramente più vite.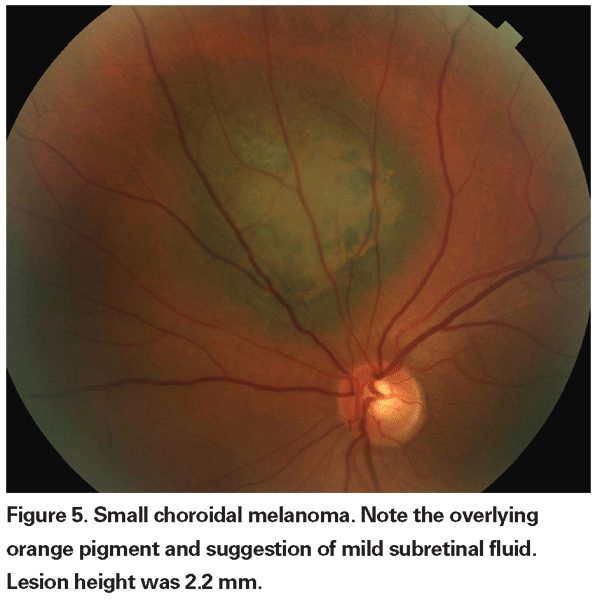
Per riassumere, le lesioni pigmentate coroideali possono essere raggruppate in tre categorie: 1) piccole lesioni piatte che sono chiaramente nevi coroideali; 2) piccole lesioni con elevazione <2,5 mm che possono avere pigmento arancione o fluido sottoretinico o uno degli altri fattori che sollevano il sospetto di malignità – le cosiddette lesioni indeterminate; e 3) tumori coroideali a cupola o a fungo maggiori/uguali a 2,5 mm che sono chiaramente melanomi. È il trattamento delle lesioni indeterminate che rimane ancora un’area di controversia, e la valutazione e la gestione di queste lesioni è meglio eseguita da oncologi oculari. Uno studio clinico che confronti il trattamento precoce con quello ritardato per le lesioni indeterminate potrebbe non essere fattibile a causa del gran numero di pazienti e della lunghezza del follow-up necessario per ottenere risultati conclusivi. Con i continui progressi nelle tecniche di diagnostica molecolare, la migliore speranza per aumentare la sopravvivenza dei pazienti con melanoma coroideale risiede nello sviluppo di trattamenti efficaci per la malattia metastatica e nella ricerca di biomarcatori che possano predire più precisamente la trasformazione maligna.
Il dottor Eichhorn-Mulligan è specializzando in oftalmologia alla Harvard Medical School. Il Dr. Kim è professore assistente nel Dipartimento di Oftalmologia presso la Harvard Medical School, Retina Service, Massachusetts Eye and Ear Infirmary.
1. Sumich P, Mitchell P, Wang J. Nevi coroideali in una popolazione bianca – il Blue Mountains Eye Study. Arch of Ophthalmol 1998;116: 645-650.
2. Shields CL, Furuta M, Mashayekhi A, Berman EL, Zahler JD, Hoberman DM, Dinh DH, Shields JA. Spettro clinico dei nevi coroideali basato sull’età di presentazione in 3.422 occhi consecutivi. Oftalmologia 2007: Dec 5 .
3. Singh AD, Kalyani P, Topham A. Stima del rischio di trasformazione maligna di un nevo coroideale. Ophthalmology 2005;112: 1784-1789.
4. Gonder JR, Augsburger JJ, McCarthy EF, Shields JA. Perdita visiva associata a nevi coroideali. Ophthalmology 1982;89:961-965.
5. Tamler E, Maumenee AE. Studio clinico dei nevi coroideali. Arch Ophthalmol 1959;62:196-202.
6. Flindall RJ, Drance SM. Studi di campo visivo di melanomi coroideali benigni. Arch Ophthalmol 1969;81:41-44.
7. Shields CL, Furuta M, Mashayekhi A, Berman EL, Zahler JD, Hoberman DM, Dinh DH, Shields JA. Acuità visiva in 3.422 occhi consecutivi con nevo coroideale. Arch Ophthalmol 2007;125:1501-1507.
8. Yanoff M, Zimmerman LE. Istogenesi dei melanomi maligni dell’uvea. II. Relazione dei nevi uveali ai melanomi maligni. Cancer 1967;20:493-507.
9. Ganley JP, Comstock GW. Nevi benigni e melanomi maligni della coroide. Am J Ophthalmol 1973;76:19-25.
10. Thiagalingam S, Wang JJ, Mitchell P. Assenza di cambiamento nei nevi coroideali attraverso 5 anni in una popolazione anziana. Arch Ophthalmol 2004;122:89-93.
11. MacIlwaine WA, Anderson B Jr, Klintworth GK. Allargamento di un nevo coroide documentato istologicamente. Am J Ophthalmol 1979;87:480-486.
12. Elner VM, Flint A, Vine AK. Istopatologia della crescita documentata nei piccoli tumori coroideali melanocitici. Arch Ophthalmol 2004;122:1876-1878.
13. Shields CL, Shields JA, Kiratli H, De Potter P, Cater JR. Fattori di rischio per la crescita e la metastasi di piccole lesioni melanocitiche coroideali. Ophthalmology 1995;102:1351-1361.
14. Shields CL, Cater J, Shields JA, Singh AD, Santos MCM, Carvalho C. Combinazione di fattori clinici predittivi della crescita di piccoli tumori melanocitici coroideali. Arch Ophthalmol 2000;118:360-364.
15. Il gruppo di studio collaborativo sul melanoma oculare. Fattori predittivi della crescita e del trattamento del piccolo melanoma coroideale. Arch Ophthalmol 1997;115:1537-1544.
16. Butler P, Char DH, Zarbin M, Kroll S. Storia naturale dei tumori coroideali pigmentati indeterminati. Ophthalmology 1994;101: 710-716.
17. Espinoza G, Rosenblatt B, Harbour W. Tomografia a coerenza ottica nella valutazione dei cambiamenti retinici associati a sospetti tumori melanocitari coroideali. Am J Ophthalmol 2004;137:90-95.
18. Il gruppo di studio collaborativo sul melanoma oculare. The COMS randomized trial of iodine 125 brachytherapy for choroidal melanoma: V. Twelve-year mortality rates and prognostic factors: COMS report No. 28. Arch Ophthalmol 2006;1684-1693.
19. Hawkins BS, Il gruppo di studio collaborativo sul melanoma oculare. The Collaborative Ocular Melanoma Study (COMS) randomized trial of pre-enucleation radiation of large choroidal melanoma: IV. Risultati di mortalità a dieci anni e fattori prognostici. COMS report no. 24. Am J Ophthalmol 2004;138:936-951.
20. The Collaborative Ocular Melanoma Study Group. Mortalità nei pazienti con piccolo melanoma coroideale. Arch of Ophthalmol 1997;115:886-893.
21. Sobrin L, Schiffman JC, Markoe AM, Murray TG. Esiti della radioterapia a placche di iodio 125 dopo l’osservazione iniziale di sospetti piccoli melanomi coroideali. Ophthalmology 2005;112:1777-1783.
22. Augsburger JJ, Vrabec TR. Impact of delayed treatment in growing posterior uveal melanomas. Arch Ophthalmol 1993;111:1382-6.