1. Überblick über den Erk-Signalweg
Der Weg der extrazellulär-signalregulierten Kinase (ERK) ist eine der wichtigsten Signalkassetten des Mitogen-aktivierten Proteinkinase (MAPK)-Signalweges. Die ERK-Kaskade wird durch eine Vielzahl von extrazellulären Wirkstoffen aktiviert, darunter Wachstumsfaktoren, Hormone und auch zellulärer Stress, um zelluläre Prozesse auszulösen, zu denen vor allem Proliferation und Differenzierung, unter bestimmten Bedingungen aber auch Stressreaktionen und andere gehören. Die wichtigsten MAPK/ERK-Kinase-Kinase-Komponenten (MEKK) sind die Mitglieder der Raf-Familie Raf-1, A-Raf und B-Raf, die zwei Serinreste an den MAPK/ERK-Kinase-Komponenten (MEK) MEK1/2 phosphorylieren. ERK1/2 sind für die Stimulierung der nachgeschalteten Effektoren verantwortlich, von denen viele Transkriptionsfaktoren sind. Einer der wichtigsten Transkriptionsfaktoren ist das cyclic AMP response element-binding protein (CREB).
Dieser ERK-Weg trägt zur Kontrolle einer großen Anzahl von zellulären Prozessen bei:
– Regulierung der Zellproliferation wie die T-Zell-Aktivierung
– Synaptische Plastizität wie die LangzeitLangzeitpotenzierung (LTP) in Hippocampus-Neuronen
– Proliferation von Endothelzellen während der Angiogenese
– Phosphorylierung des Transkriptionsfaktors p53
– Die Umgestaltung des ERK-Signalwegs kann zur Entwicklung der polyzystischen Nierenerkrankung beitragen
– Aktivierung der Phospholipase A2 (PLA2) in Mastzellen.
2. ERK-Signalkaskade
Die Aktivierung der ERK1/2-Kaskade wird meist an Membranrezeptoren, wie Rezeptor-Tyr-Kinasen (RTKs), G-Protein-gekoppelten Rezeptoren (GPCRs), Ionenkanälen und anderen, ausgelöst. Diese Rezeptoren leiten das Signal weiter, indem sie Adaptorproteine (z. B. Grb2) und Austauschfaktoren (z. B. SOS) rekrutieren, die wiederum die Aktivierung von Ras an den Plasmamembranen oder Membranen anderer Organellen einleiten. Das aktivierte, GTP-gebundene Ras überträgt dann das Signal durch Aktivierung der Proteinkinasen Raf-1, B-Raf und A-Raf (Rafs) innerhalb der MAP3K-Ebene dieser Kaskade. Diese Aktivierung erfolgt durch Rekrutierung der Rafs an die Membranen, wo sie dann phosphoryliert und aktiviert werden. MOS ist ein weiterer MAP3K der ERK-Kaskade, der jedoch hauptsächlich im Fortpflanzungssystem durch eine andere Art der Regulierung wirkt. Von der MAP3K-Ebene aus wird das Signal dann über die MAPKK-Komponenten die Kaskade hinunter weitergeleitet: MEK1/2. Sie werden durch Serinphosphorylierung an dem MAPKK-typischen Ser-Xaa-Ala-Xaa-Ser/Thr-Motiv in ihrer Aktivierungsschleife aktiviert. Die MEK1/2 aktivieren ihrerseits ihre einzigen bekannten Substrate, die nativen ERK1/2, die als ihre einzigen nachgeschalteten Ziele fungieren, was darauf hindeutet, dass die MEK1/2 als spezifitätsbestimmende Komponenten der ERK1/2-Kaskade dienen. Die MEK1/2 sind die einzigen dual-spezifischen Proteinkinasen, die sowohl regulatorische Thr- als auch Tyr-Reste der ERK1/2 phosphorylieren können. Bislang wurden etwa 200 verschiedene Substrate von ERK1/2 identifiziert. Es handelt sich dabei um Substrate, die entweder im Zytosol (z.B. PLA2 RSK) oder nach der Translokation im Zellkern vorkommen, darunter Transkriptionsfaktoren wie Elk1, c-Fos und c-Jun.
– MAP3K-Raf 1
Raf-1 ist das am besten untersuchte der Wachstumsfaktor-Signalmoleküle auf der MAP3K-Ebene der Kaskade. Es handelt sich um eine 70- bis 75-kDa-Protein-Serin/Threonin-Kinase, die eine Kinase-Domäne in der COOH-terminalen Hälfte des Moleküls und eine regulatorische Domäne in der übrigen Hälfte enthält. Bei Stimulation mit verschiedenen Mitogenen wird Raf-1 innerhalb von 2-3 mm vorübergehend aktiviert. Der Mechanismus der Aktivierung von Raf-1 ist in den letzten Jahren eingehend untersucht worden. Es ist jetzt klar, dass Raf-1 stromabwärts von HAS liegt, das bei Stimulation direkt mit dem NH2-terminalen Teil von Raf-1 zu interagieren scheint.
– MAPKK-MEK1/2
Die MEKs bilden eine evolutionär konservierte Familie von Protein-Serin/Threonin-Kinasen, die bis heute drei hoch homologe (85%) Säugetier-Isoformen umfasst. Der Mechanismus der MEK-1-Aktivierung beinhaltet eine Proteinphosphorylierung nur an Serinresten und scheint ähnlich zu sein, unabhängig davon, ob die Phosphorylierung durch MEKK, Raf-1 oder durch Autophosphorylierung erfolgt, wie durch Phosphopeptidkarten festgestellt wurde. MAPKKs (MEKs) sind hochspezifisch für die nachgeschalteten Komponenten ERK-1 und ERK-2. Darüber hinaus erkannte MAPKK weder die denaturierte Form seines Substrats noch Peptide, die die Phosphorylierungsstellen in ERK enthalten, was darauf hindeutet, dass das Enzym die native Form von MAPK benötigt.
– MAPK-ERK-1/2
Aufgrund ihrer großen Ähnlichkeit werden ERK-1 und ERK-2 normalerweise als funktionell redundant angesehen. Der wichtigste Upstream-Mechanismus, der zur Phosphorylierung von ERK-1 und -2 an diesen beiden regulatorischen Resten führt, ist ihre Phosphorylierung durch MEK. Da die ERKs ein recht breites Spektrum an Substraten erkennen, können sie nach ihrer Aktivierung eine große Anzahl von Proteinen phosphorylieren. Diese Proteine sind häufig regulatorischer Natur und befinden sich sowohl im Zytoplasma als auch im Zellkern.
3. Downstream-Signalisierung des Erk-Wegs
– Zellproliferation
Aktivierte ERK1/2 phosphoryliert RSK, und sowohl RSK als auch ERK translozieren in den Zellkern, wo sie mehrere Transkriptionsfaktoren wie CREB, Fos und Elk-1 aktivieren, was letztlich zur Synthese von Effektorproteinen führt und Veränderungen in der Zellproliferation und im Überleben bewirkt. CREB (cAMP response element-binding protein) ist ein zellulärer Transkriptionsfaktor, der die Gentranskription um mehr als das Zehnfache verstärken kann. c-fos ist ein 380 Aminosäuren umfassendes Protein mit einer basischen Leuzin-Zipper-Region zur Dimerisierung und DNA-Bindung und einer Transaktivierungsdomäne am C-Terminus. Es ist an wichtigen zellulären Vorgängen beteiligt, u. a. an der Zellproliferation, der Zelldifferenzierung und dem Überleben. Das ETS domain-containing protein (Elk-1) ist ein Protein, das beim Menschen durch das ELK1-Gen kodiert wird. Elk-1 fungiert auch als Transkriptionsaktivator.
– Onkogenese
Die ERK1/2-Aktivierung fördert die Metaplasie und die Tumorentwicklung, indem sie Bim und Bid phosphoryliert und den Proteasom-Abbau von Bim und die Sequestrierung von Bad an die Phosphoserin-bindenden Proteine bewirkt und dadurch die Apoptose hemmt. Auf einem anderen Weg phosphoryliert die ERK1/2-Aktivierung FOXO3a an Ser 294, Ser 344 und Ser 425 und erleichtert die FOXO3a-MDM2-Interaktion. Diese Interaktion fördert den Abbau von FOXO3a über einen MDM2-abhängigen Ubiquitin-Proteasom-Weg, was zur Tumorentwicklung führt.
– Entwicklung und Differenzierung
Die Signalübertragung durch Rezeptortyrosinkinasen, die den Ras/Raf/MAP-Kinase-Weg aktivieren, reguliert die Entwicklung und Differenzierung vieler Zelltypen. Hauptsächlich durch die Aktivierung der Signaltransduktoren und Aktivatoren von Transkriptionsproteinen (STATs).
– Zellzyklus
Cdc25 aktiviert Cyclin-abhängige Kinasen, indem es Phosphat von Resten im aktiven Zentrum von Cdk entfernt. Es ist bekannt, dass es die Übergänge von G1 zur S-Phase und G2 zur M-Phase kontrolliert. Erk1/2 kann das Cdc25-Protein aktivieren und damit die Progression des Zellzyklus fördern.
4. Regulierung der Erk-Signalisierung
Die Regulierung der Erk-Signalisierung ist sehr wichtig für die Aufrechterhaltung der normalen Funktion der Zellen. Es gibt mehrere Regulierungsstrategien für die Zelle, um den Erk-Signalweg zu regulieren, vor allem die Regulierung durch Rückkopplungsschleifen, durch auf- und abwärtsgerichtete Gerüste, durch Phosphatase und Inhibitoren des Erk-Signalwegs.
– Rückkopplungsschleifen-Regulierung
Es gibt mehrere Punkte negativer Rückkopplung im ERK-Signalweg (Abbildung 1). MEK ist ein Ziel und kann durch ERK-Phosphorylierung von MEK1/2 an Thr292 und Thr212 gehemmt werden. Die Phosphorylierung verhindert eine weitere Verstärkung der MEK-Aktivität durch PAK1 und verringert dadurch die Aktivierung von ERK. Die Phosphorylierung von Raf an mehreren Stellen durch ERK stellt einen zweiten möglichen Rückkopplungsmechanismus dar. Die Hyperphosphorylierung dieser Stellen verhindert die Interaktion von Raf mit der Ras-GTPase und fördert seine Dephosphorylierung durch die Phosphatase PP2A. Die Aktivierung oder transkriptionelle Hochregulierung von Phosphatasen durch ERK ist ein alternativer negativer Rückkopplungsmechanismus. Diese verschiedenen ERK-aktivierten negativen Rückkopplungsschleifen stellen ein Mittel dar, um die Signaldauer zu begrenzen und den Signalweg in den Grundzustand zurückzuführen.
– Auf- und Abwärtsregulierung durch Gerüstproteine
Gerüstproteine binden zwei oder mehr Komponenten eines Signalwegs, um sie in die Nähe zu bringen und dadurch ihre funktionelle Interaktion zu erleichtern. Darüber hinaus können Gerüstproteine diese Multi-Enzym-Signalmodule auf verschiedene zelluläre Orte ausrichten und dadurch die Phosphorylierung einer bestimmten Untergruppe von nachgeschalteten Substraten fördern. Scaffolds beeinflussen auch die Dauer des Signals, verhindern den Crosstalk zwischen ähnlichen Signalwegen und können die Aktivierung des Signalmoduls an ein spezifisches aktivierendes Upstream-Signal binden.
– Phosphatase und Inhibitoren
Die Aktivität der MAPK-Signalwege wird durch die konkurrierenden Aktionen von Upstream-Kinasen und hemmenden Phosphatasen bestimmt. Die MAPK-Signalwege werden durch Dephosphorylierung ihrer Komponenten durch verschiedene Phosphatasen beendet. Mehrere Serin/Threonin-Phosphatasen, wie PP2A und PP2Ca, und Tyrosin-Phosphatasen, wie PTP-SL und HePTP, sind nachweislich in der Lage, MAPKs zu inaktivieren.
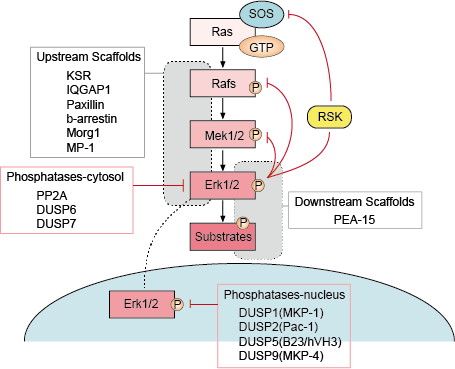
Abbildung 1. Regulierung des Erk-Signalweges
5. Beziehung zu Krankheiten
Die MAPK-Signalwege sind aufgrund ihrer entscheidenden Rolle bei wichtigen zellulären Aktivitäten, einschließlich Zellproliferation, Differenzierung und Überleben oder Tod, in die Pathogenese vieler menschlicher Krankheiten verwickelt.
– Alzheimer-Krankheit
Die Alzheimer-Krankheit (AD) ist eine neurodegenerative Erkrankung, die durch kognitive und Gedächtnisstörungen gekennzeichnet ist und von der man annimmt, dass sie aus der Bildung von senilen Plaques, die Amyloid-β (Aβ) enthalten, und neurofibrillären Tangles, die das Mikrotubuli assoziierte Protein Tau enthalten, im Gehirn resultiert. Es gibt daher Hinweise darauf, dass MAPK-Signalwege durch die Regulierung der neuronalen Apoptose, der β- und γ-Sekretaseaktivität und der Phosphorylierung von APP und Tau zur Pathogenese der Alzheimer-Krankheit beitragen können.
– Parkinson-Krankheit
Die Parkinson-Krankheit (PD) ist die zweithäufigste neurodegenerative Erkrankung. Verschiedene Beobachtungen deuten darauf hin, dass MAPK-Signalwege zu neuroinflammatorischen Reaktionen und zum Tod von Neuronen beitragen, die durch α-Synuclein-Aggregate oder funktionelle Defizite von Parkin oder DJ-1 in der Pathogenese der Parkinson-Krankheit ausgelöst werden.
– MAPK-Signalwege bei Krebs
Viele der krebsassoziierten Mutationen von Komponenten der MAPK-Signalwege wurden in Ras und B-Raf gefunden, die beide am ERK-Signalweg beteiligt sind. Der ERK-Signalweg spielt bei mehreren Schritten der Tumorentwicklung eine Rolle. Die Phosphorylierung von Proteinen wie Myosin Light Chain Kinase, Calpain, Focal Adhesion Kinase und Paxillin durch ERK fördert die Migration von Krebszellen. Darüber hinaus reguliert die ERK1/2-Signalübertragung die Aktivitäten und Konzentrationen von Proteinen der Bcl-2-Familie wie dem pro-apoptotischen Protein BIM und dem anti-apoptotischen Protein MCL-1 und fördert so das Überleben von Krebszellen.
| Keshet Y, Seger R. The MAP kinase signaling cascades: a system of hundreds of components regulates a diverse array of physiological functions. MAP Kinase Signaling Protocols: Second Edition, 2010: 3-38. | |
| Wortzel I, Seger R. The ERK cascade distinct functions within various subcellular organelles. Genes & cancer, 2011, 2(3): 195-209. | |
| Ramos J W. The regulation of extracellular signal-regulated kinase (ERK) in mammalian cells. The international journal of biochemistry & cell biology, 2008, 40(12): 2707-2719. | |
| Shaul Y D, Seger R. The MEK/ERK cascade: from signaling specificity to diverse functions. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2007, 1773(8): 1213-1226. | |
| Yao Z, Seger R. The ERK signaling cascade—views from different subcellular compartments. Biofactors, 2009, 35(5): 407-416. |