Carcini formale
Moleculele organice pot avea asociate sarcini pozitive sau negative. În timpul reacțiilor chimice, este obișnuit ca reactantul, intermediarii și/sau produsele să aibă sarcini. Recunoașterea și distincția între modelele de legături neutre și încărcate va fi utilă în învățarea mecanismelor de reacție. Luați în considerare structura Lewis a metanolului, CH3OH (metanolul este așa-numitul „alcool de lemn” pe care contrabandiștii fără scrupule îl vindeau uneori în timpul prohibiției din anii 1920, provocând adesea orbirea persoanelor care îl beau). Metanolul în sine este o moleculă neutră, dar poate pierde un proton pentru a deveni un anion molecular (CH3O-) sau poate câștiga un proton pentru a deveni un cation molecular (CH3OH2+).

Anionul și cationul molecular au sarcini globale de -1 și, respectiv, +1. Dar putem fi mai specifici decât atât – putem afirma, de asemenea, pentru fiecare ion molecular, că o sarcină formală este localizată în mod specific pe atomul de oxigen, mai degrabă decât pe atomul de carbon sau pe oricare dintre atomii de hidrogen.
Determinarea sarcinii formale pe diferiți atomi dintr-o moleculă este un proces simplu – este pur și simplu o chestiune de însumare a electronilor de valență.
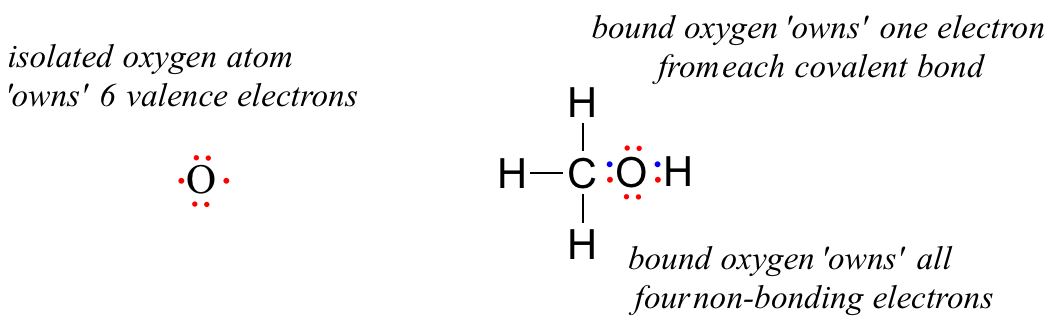
Un atom de oxigen nelegat are 6 electroni de valență. Cu toate acestea, atunci când este legat ca parte a unei molecule de metanol, un atom de oxigen este înconjurat de 8 electroni de valență: 4 electroni nelegate (două „perechi singuratice”) și 2 electroni în fiecare dintre cele două legături covalente (una cu carbonul, una cu hidrogenul). În convenția de sarcină formală, spunem că oxigenul „deține” toți cei 4 electroni nelegatari. Cu toate acestea, el „deține” doar un singur electron din fiecare dintre cele două legături covalente, deoarece legăturile covalente implică schimbul de electroni între atomi. Prin urmare, atomul de oxigen din metanol deține 2 + 2 + (½ x 4) = 6 electroni de valență.
The formal charge on an atom is calculated as the number of valence electrons owned by the isolated atom minus the number of valence electrons owned by the bound atom in the molecule:
Determining formal charge on an atom
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of valence electrons owned by the bound atom)
or . . .
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of non-bonding electrons on the bound atom)
– ( ½ the number of bonding electrons on the bound atom)
Using this formula for the oxygen atom of methanol, we have:
formal charge on oxygen =
(6 valence electrons on isolated atom)
– (4 non-bonding electrons)
– (½ x 4 bonding electrons)
= 6 – 4 – 2 = 0. Thus, oxygen in methanol has a formal charge of zero (in other words, it has no formal charge).
How about the carbon atom in methanol? An isolated carbon owns 4 valence electrons. The bound carbon in methanol owns (½ x 8) = 4 valence electrons:
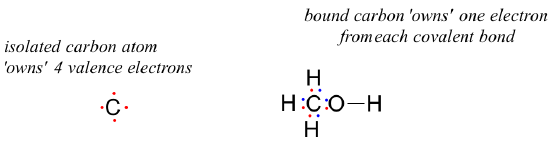
formal charge on carbon =
(4 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 8 bonding electrons)
= 4 – 0 – 4 = 0. So the formal charge on carbon is zero.
For each of the hydrogens in methanol, we also get a formal charge of zero:
formal charge on hydrogen =
(1 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 2 bonding electrons)
= 1 – 0 – 1 = 0
Now, let’s look at the cationic form of methanol, CH3OH2+. The bonding picture has not changed for carbon or for any of the hydrogen atoms, so we will focus on the oxygen atom.
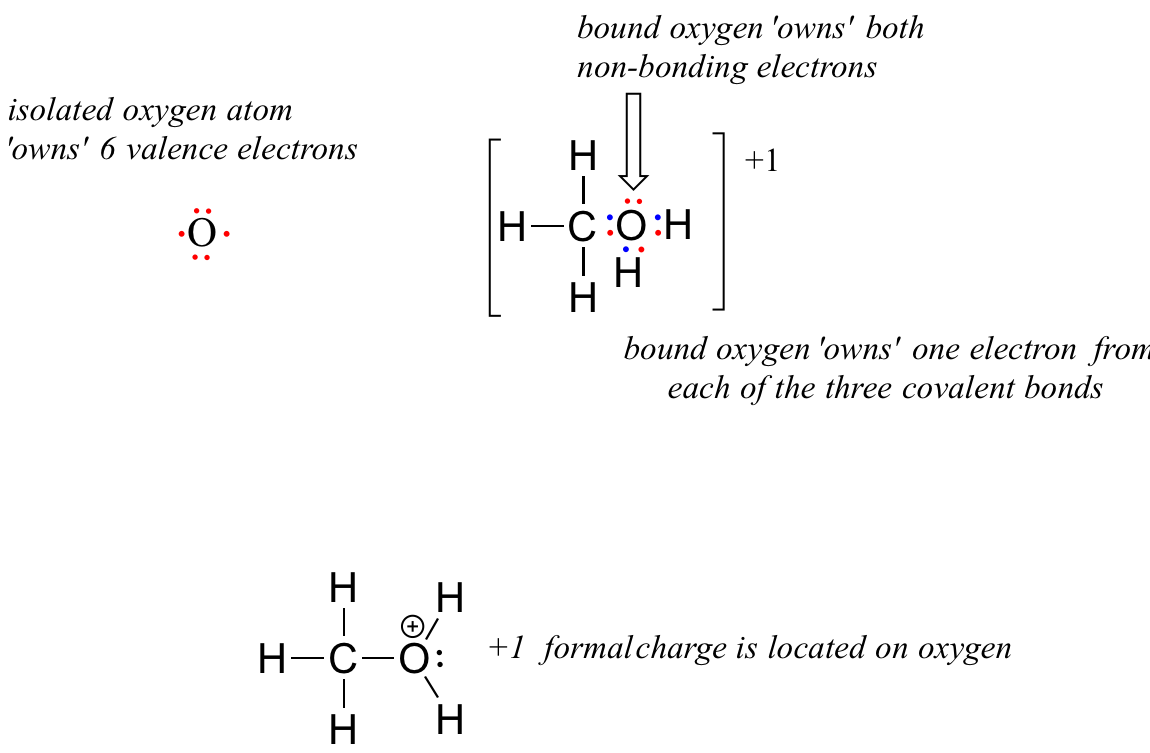
The oxygen owns 2 non-bonding electrons and 3 bonding elections, so the formal charge calculations becomes:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (2 non-bonding electrons)
– (½ x 6 bonding electrons)
= 6 – 2 – 3 = 1. A formal charge of +1 is located on the oxygen atom.
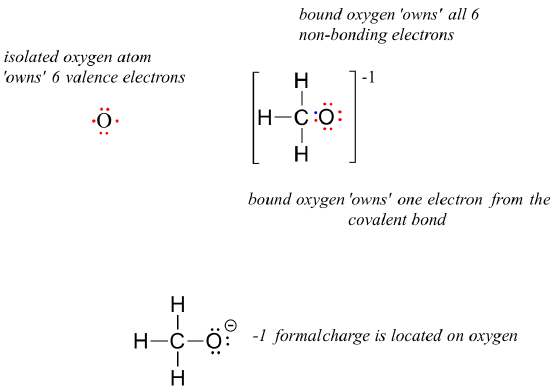
For methoxide, the anionic form of methanol, the calculation for the oxygen atom is:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (6 non-bonding electrons)
– (½ x 2 bonding electrons)
= 6 – 6 – 1 = -1. A formal charge of -1 is located on the oxygen atom.
A very important rule to keep in mind is that the sum of the formal charges on all atoms of a molecule must equal the net charge on the whole molecule.
Când se desenează structurile moleculelor organice, este foarte important să se arate toate sarcinile formale care nu sunt egale cu zero, fiind clar unde sunt localizate sarcinile. O structură din care lipsesc sarcinile formale diferite de zero nu este desenată corect și, probabil, va fi notată ca atare la un examen!
În acest moment, gândindu-vă la ceea ce ați învățat în chimia generală, probabil că vă întrebați: „Cum rămâne cu dipolii? Nu cumva un atom de oxigen într-o legătură O-H „deține” mai multă densitate de electroni decât hidrogenul, din cauza electronegativității sale mai mari?”. Acest lucru este absolut corect și vom trece în revistă conceptul de dipoli de legătură mai târziu. Cu toate acestea, în scopul calculării sarcinilor formale, dipolii de legătură nu contează – considerăm întotdeauna că cei doi electroni dintr-o legătură sunt împărțiți în mod egal, chiar dacă acest lucru nu reflectă cu exactitate realitatea chimică. Sarcinile formale sunt doar atât – o formalitate, o metodă de evidență a electronilor care este legată de sistemul Lewis pentru desenarea structurilor compușilor organici și a ionilor. Mai târziu, vom vedea cum conceptul de sarcină formală ne poate ajuta să vizualizăm modul în care reacționează moleculele organice.
În cele din urmă, nu vă lăsați ademenit să credeți că, doar pentru că sarcina netă pe o structură este zero, nu există atomi cu sarcini formale: un atom ar putea avea o sarcină formală pozitivă și altul o sarcină formală negativă, iar sarcina netă ar fi tot zero. Zwitterionii, cum ar fi aminoacizii, au atât sarcini formale pozitive, cât și negative pe diferiți atomi:

Chiar dacă sarcina netă pe glicină este zero, este totuși necesar să se arate locația sarcinilor formale pozitive și negative.
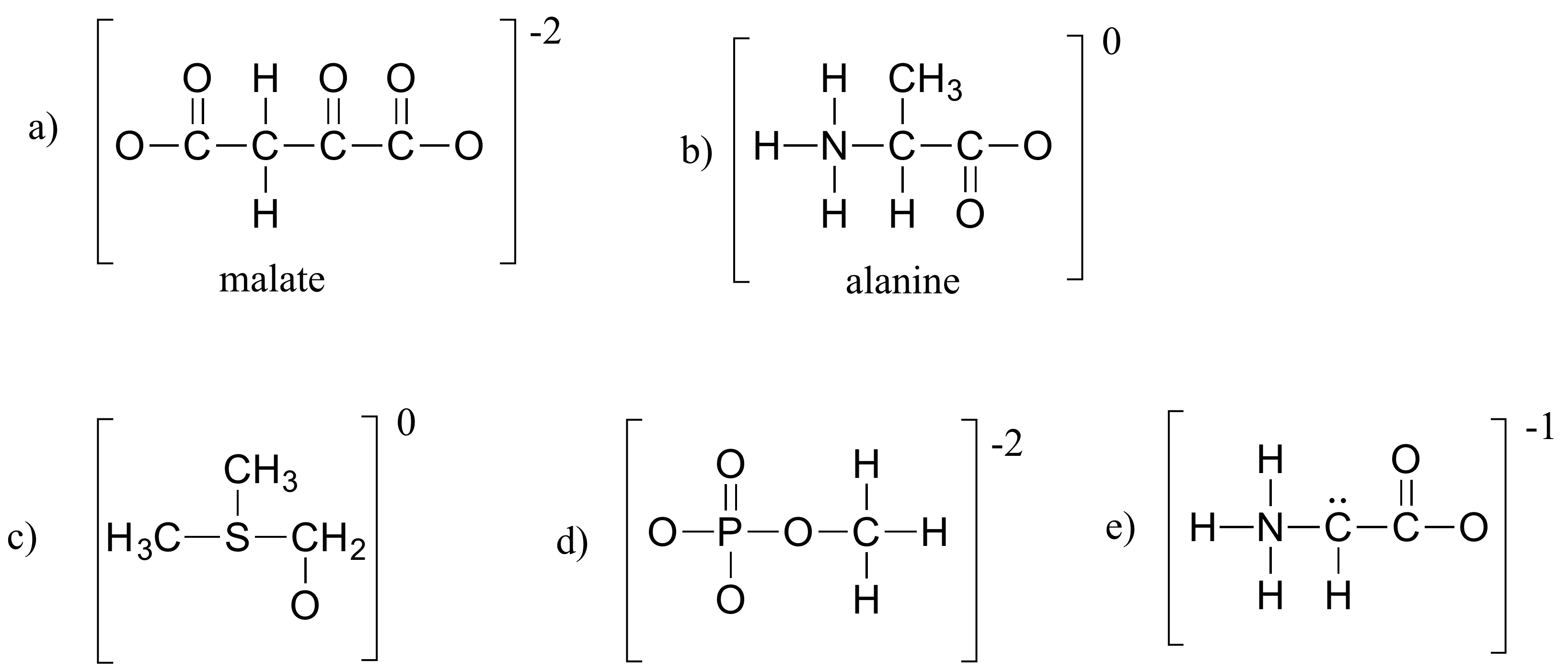
Exercițiu 1.4
Completați toți electronii perechi singuratice și sarcinile formale lipsă în structurile de mai jos. Presupuneți că toți atomii au un înveliș de valență complet de electroni. În afara parantezelor sunt indicate sarcinile nete.
Soluții la exerciții
.