Teoria MO și legăturile pi conjugate
Avantajul utilizării teoriei MO pentru a înțelege legăturile din moleculele organice devine mai evident atunci când ne gândim la legăturile pi. Să luăm mai întâi în considerare legătura pi din etenă din punctul de vedere al teoriei MO (în acest exemplu vom ignora legăturile s din moleculă și ne vom gândi doar la legătura π). Începem cu doi orbitali atomici: un orbital 2p nehibridat de la fiecare carbon. Fiecare conține un singur electron. În teoria MO, cei doi atomi se combină matematic pentru a forma doi orbitali moleculari pi, un orbital de legătură pi de energie joasă și un orbital de antilegătură pi* de energie înaltă.

Orbitali moleculari pentru etenă (etilenă)
În orbitalul pi de legătură, cei doi lobi umbriți ai orbitalilor p interacționează constructiv unul cu celălalt, la fel ca și cei doi lobi neumbriți (rețineți, alegerea arbitrară a umbririi reprezintă semnele matematice (+) și (-) pentru funcția de undă matematică care descrie orbitalul). Există o densitate crescută de electroni între cele două nuclee de carbon în orbitalul molecular – este o interacțiune de legătură.
În orbitalul pi* antilegătură de energie mai mare, lobul umbrit al unui orbital p interacționează distructiv cu lobul neumbrit al celui de-al doilea orbital p, ceea ce duce la un nod între cele două nuclee și la o repulsie generală între nucleele de carbon.
Utilizând din nou principiul „construirii”, plasăm cei doi electroni în orbitalul molecular pi cu energie mai mică, de legătură. Orbitalul pi* anti-legătură rămâne gol.
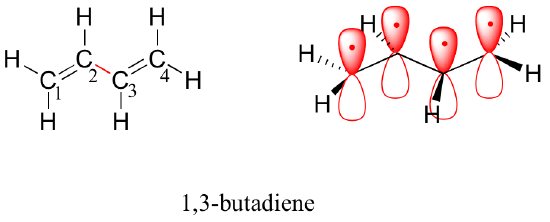
În continuare, vom lua în considerare molecula de 1,3-butadienă. Numai din teoria orbitalului de valență ne-am putea aștepta ca legătura C2-C3 din această moleculă, deoarece este o legătură sigma, să se poată roti liber.

Experimental, totuși, se observă că există o barieră semnificativă în calea rotației în jurul legăturii C2-C3 și că întreaga moleculă este plană. În plus, legătura C2-C3 are o lungime de 148 pm, mai scurtă decât o legătură simplă carbon-carbon tipică (aproximativ 154 pm), deși mai lungă decât o legătură dublă tipică (aproximativ 134 pm).
Teoria orbitalelor moleculare explică aceste observații cu ajutorul conceptului de legături pi delocalizate. În această imagine, cei patru orbitali atomici 2p se combină matematic pentru a forma patru orbitali moleculari pi de energie crescătoare. Doi dintre aceștia – orbitalii pi de legătură – au o energie mai mică decât orbitalii atomici p din care sunt formați, în timp ce doi – orbitalii pi* de antilegătură – au o energie mai mare.

Orbitalul molecular cu cea mai mică energie, pi1, are doar interacțiune constructivă și noduri zero. Cu o energie mai mare, dar tot mai mică decât cea a orbitalilor p izolați, orbitalul pi2 are un nod, dar două interacțiuni constructive – prin urmare, este tot un orbital de legătură în ansamblu. Dacă ne uităm la cei doi orbitali anti-legătură, pi3* are două noduri și o interacțiune constructivă, în timp ce pi4* are trei noduri și zero interacțiuni constructive.
Potrivit principiului aufbau, cei patru electroni din orbitalii atomici 2pz izolați sunt plasați în MO-urile de legătură pi1 și pi2. Deoarece pi1 include interacțiunea constructivă între C2 și C3, există un grad, în molecula de 1,3-butadienă, de interacțiune de legătură pi între acești doi carboni, ceea ce explică lungimea mai mică a acesteia și bariera la rotație. Imaginea legăturii de valență a 1,3-butadienei arată cele două legături pi ca fiind izolate una de cealaltă, cu fiecare pereche de electroni pi „prinsă” în propria legătură pi. Cu toate acestea, teoria orbitalului molecular prezice (cu exactitate) că cei patru electroni pi sunt într-o oarecare măsură delocalizați, sau „împrăștiați”, pe întregul sistem pi.
Vedere de umplere a spațiului
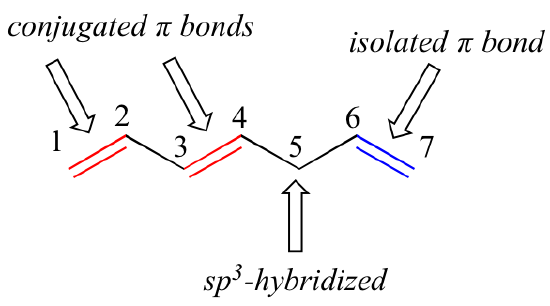
1,3-butadiena este cel mai simplu exemplu de sistem de legături pi conjugate. Pentru a fi considerate conjugate, două sau mai multe legături pi trebuie să fie separate de o singură legătură – cu alte cuvinte, nu poate interveni un carbon hibridizat sp3, deoarece acest lucru ar rupe sistemul suprapus de orbitali p paraleli. În compusul de mai jos, de exemplu, dublele legături C1-C2 și C3-C4 sunt conjugate, în timp ce dubla legătură C6-C7 este izolată de celelalte două legături pi de către C5 hibridizat sp3.
Un concept foarte important de reținut este acela că există o stabilitate termodinamică inerentă asociată cu conjugarea. Această stabilitate poate fi măsurată experimental prin compararea căldurii de hidrogenare a doi dieni diferiți. (Hidrogenarea este un tip de reacție despre care vom învăța mult mai multe în capitolul 15: în esență, este procesul de adăugare a unei molecule de hidrogen – doi protoni și doi electroni – la o legătură p). Atunci când cele două duble legături conjugate ale 1,3-pentadienei sunt „hidrogenate” pentru a produce pentan, se eliberează aproximativ 225 kJ pe mol de pentan format. Comparați acest lucru cu cei aproximativ 250 kJ/mol eliberați atunci când cele două duble legături izolate din 1,4-pentadienă sunt hidrogenate, formând de asemenea pentan.

Diena conjugată are o energie mai mică: cu alte cuvinte, este mai stabilă. În general, legăturile pi conjugate sunt mai stabile decât legăturile pi izolate.
Sistemele pi conjugate pot implica atomi de oxigen și azot, precum și de carbon. În metabolismul moleculelor de grăsime, unele dintre reacțiile cheie implică alchene care sunt conjugate cu grupe carbonil.

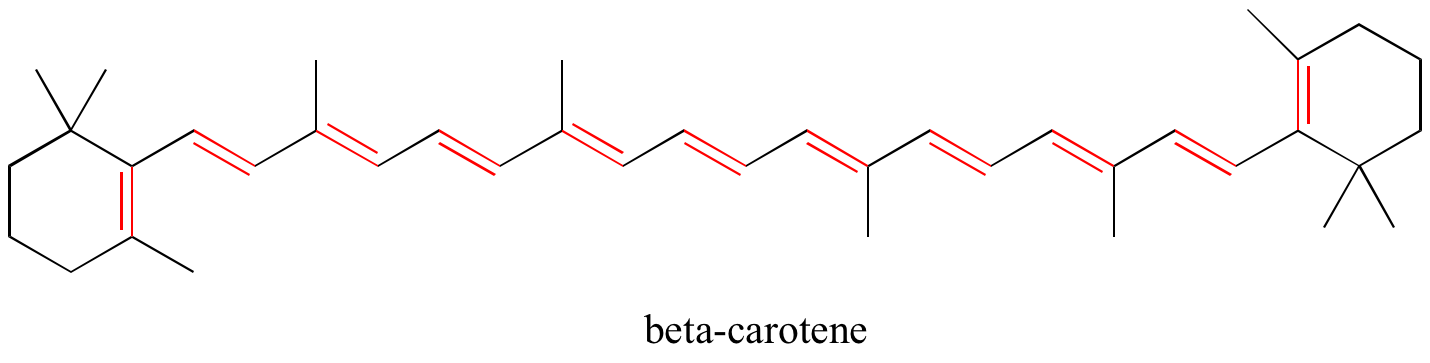
În capitolul 4, vom vedea că teoria MO este foarte utilă pentru a explica de ce moleculele organice care conțin sisteme extinse de legături pi conjugate au adesea culori distincte. Beta-carotenul, compusul responsabil pentru culoarea portocalie a morcovilor, are un sistem extins de 11 legături pi conjugate.
Exercițiu: Identificați toate legăturile duble conjugate și izolate din structurile de mai jos. Pentru fiecare sistem pi conjugat, precizați numărul de orbitali p suprapuși și câți electroni pi sunt împărțiți între ei.
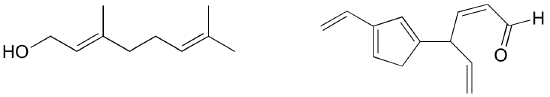
Exercițiu: Identificați toate legăturile pi izolate și conjugate din licopen, compusul de culoare roșie din roșii. Câți electroni pi sunt conținuți în sistemul pi conjugat?

Soluții la exerciții
Aromaticitatea – Sistemul conjugat suprem
Teoria orbitalilor moleculari este deosebit de utilă pentru a explica proprietățile unice ale compușilor aromatici, cum ar fi benzenul:
Model 3D interactiv al benzenului
Deși benzenul este cel mai adesea desenat cu trei legături duble și trei legături simple, de fapt toate legăturile carbon-carbon sunt exact de aceeași lungime (138 pm). În plus, legăturile pi din benzen sunt semnificativ mai puțin reactive decât legăturile pi „normale”, fie că sunt izolate sau conjugate. Ceva din structura benzenului face ca aranjamentul său de legături pi să fie deosebit de stabil. Acest „ceva” are un nume: se numește „aromaticitate”.
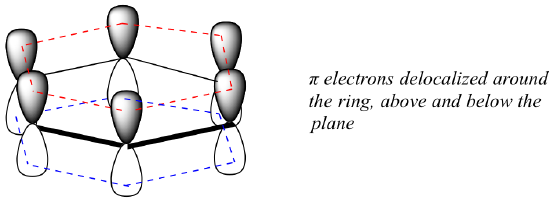
Ce anume este această proprietate „aromatică” care face ca legăturile pi din benzen să fie atât de stabile? În mare parte, răspunsul la această întrebare se află în faptul că benzenul este o moleculă ciclică în care toți atomii din inel sunt hibridizați sp2. Acest lucru permite electronilor pi să fie delocalizați în orbitali moleculari care se extind în jurul inelului, deasupra și dedesubtul planului. Pentru ca acest lucru să se întâmple, bineînțeles, inelul trebuie să fie plan – altfel orbitalii p nu s-ar putea suprapune corespunzător. Într-adevăr, se știe că benzenul este o moleculă plană.
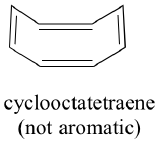
Toate moleculele ciclice cu legături simple și duble alternante au aceeași stabilitate aromatică? Răspunsul, de fapt, este „nu”. Inelul ciclooctatetraenic cu opt membri prezentat mai jos nu este plat, iar legăturile sale π reacționează ca și alchenele „normale”.
Este clar că este nevoie de ceva mai mult pentru a fi aromatică, iar acest lucru poate fi cel mai bine explicat cu ajutorul teoriei orbitalului molecular. Să ne uităm la o diagramă energetică a orbitalilor moleculari pi din benzen.

Calculele de mecanică cuantică ne spun că cei șase orbitali moleculari pi din benzen, formați din șase orbitali p atomici, ocupă patru niveluri energetice separate. Pi1 și pi6* au niveluri energetice unice, în timp ce perechile pi2 – pi3 și pi4*- pi5* sunt degenerate, ceea ce înseamnă că se află la același nivel energetic. Atunci când folosim principiul aufbau pentru a umple acești orbitali cu cei șase electroni pi din benzen, observăm că orbitalii de legătură sunt complet plini, iar orbitalii de antilegătură sunt goi. Acest lucru ne oferă un indiciu bun cu privire la sursa stabilității speciale a benzenului: un set complet de MO de legătură este similar în multe privințe cu „cochilia completă” de electroni din orbitalii atomici ai gazelor nobile stabile heliu, neon și argon.
Acum, să facem același lucru pentru ciclooctatetraen, despre care am aflat deja că nu este aromatic.
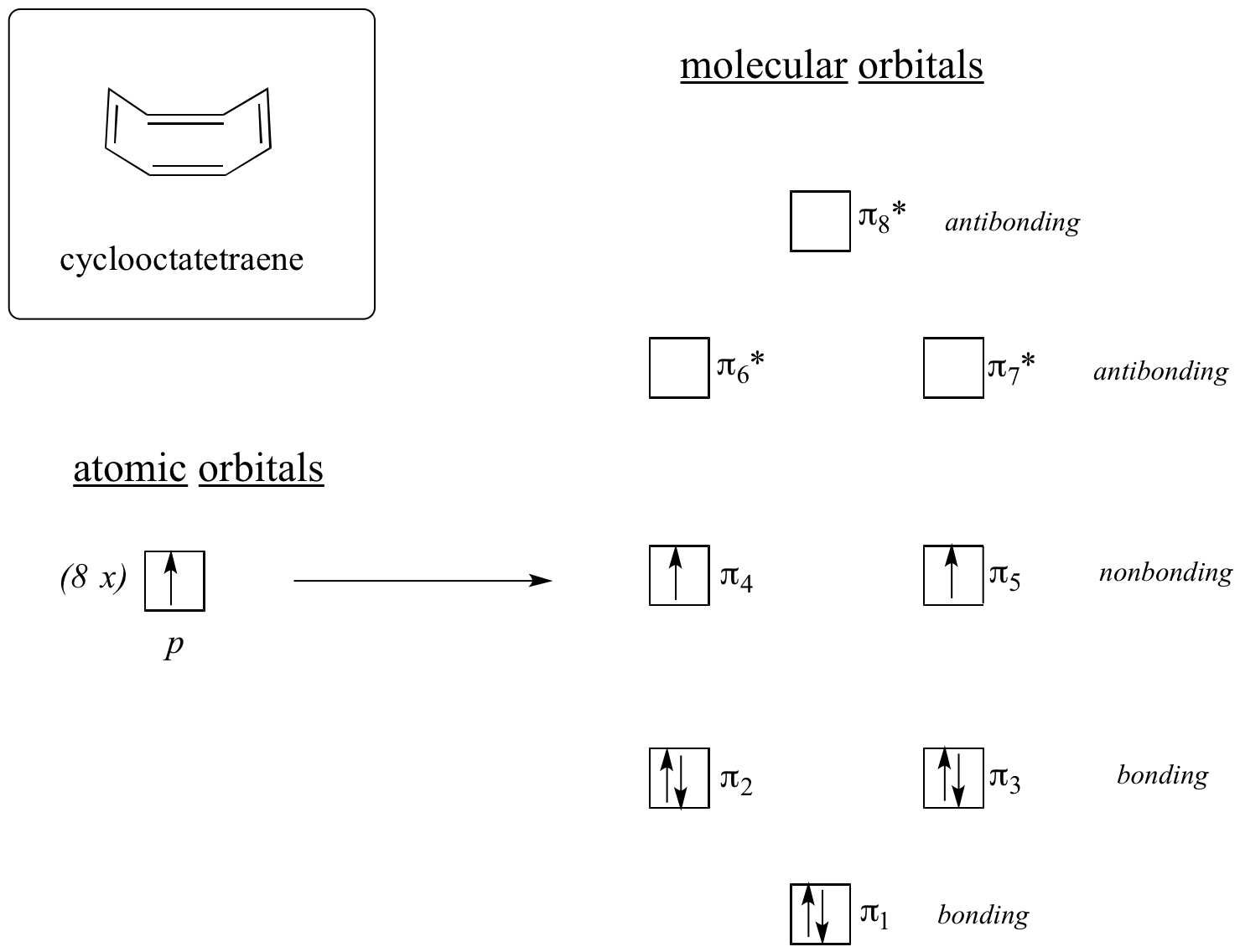
Rezultatul calculelor orbitalelor moleculare ne spune că cel mai mic și cel mai mare MO de energie (pi1 și pi8*) au niveluri energetice unice, în timp ce celelalte șase formează perechi degenerate. Observați că pi4 și pi5 se află la același nivel energetic ca și orbitalii atomici 2pz izolați: prin urmare, aceștia nu sunt nici de legătură, nici de antilegătură, ci mai degrabă sunt denumiți MO nelegate. Completând MO cu cei opt electroni pi din moleculă, constatăm că ultimii doi electroni sunt neperecheați și se încadrează în cei doi orbitali nelegatari degenerate. Deoarece nu avem o coajă perfect umplută de MO de legătură, molecula noastră nu este aromatică. În consecință, fiecare dintre legăturile duble din ciclooctatetraen se comportă mai mult ca o legătură dublă izolată.
Pentru moment, obiectivul important de învățare este să recunoaștem sistemele de legături pi conjugate și să înțelegem că benzenul este excepțional de stabil, prezentând o proprietate numită aromaticitate. Aromaticitatea și chimia compușilor aromatici este relativ complexă și este discutată mai detaliat în capitolele ulterioare ale acestui text.
Chimie organică cu accent pe biologie de Tim Soderberg (University of Minnesota, Morris)
.