Electronegativitatea și polaritatea legăturii
Deși am definit legătura covalentă ca fiind un partaj de electroni, electronii dintr-o legătură covalentă nu sunt întotdeauna împărțiți în mod egal de către cei doi atomi legați. Cu excepția cazului în care legătura conectează doi atomi ai aceluiași element, ca în cazul H2, va exista întotdeauna un atom care atrage electronii din legătură mai puternic decât celălalt atom, ca în cazul HCl, prezentat în figura \(\PageIndex{1}\). O legătură covalentă care are o împărțire egală a electronilor (Figura \(\PageIndex{1a}\)) se numește legătură covalentă nepolară. O legătură covalentă care are o împărțire inegală a electronilor, ca în figura \(\PageIndex{1b}\), se numește legătură covalentă polară.

Distribuția densității de electroni într-o legătură polară este inegală. Ea este mai mare în jurul atomului care atrage electronii mai mult decât celălalt. De exemplu, electronii din legătura H-Cl a unei molecule de clorură de hidrogen petrec mai mult timp în apropierea atomului de clor decât în apropierea atomului de hidrogen. Observați că zona umbrită din jurul lui Cl din figura \(\PageIndex{1b}\) este mult mai mare decât cea din jurul lui H.
Acest dezechilibru în densitatea de electroni are ca rezultat o acumulare de sarcină negativă parțială (desemnată ca δ-) pe o parte a legăturii (Cl) și o sarcină pozitivă parțială (desemnată ca δ+) pe cealaltă parte a legăturii (H). Acest lucru se poate observa în figura \(\PageIndex{2a}\). Separarea sarcinilor într-o legătură covalentă polară are ca rezultat un dipol electric (doi poli), reprezentat de săgeata din figura \(\PageIndex{2b}\). Direcția săgeții este îndreptată spre capătul δ-, în timp ce coada + a săgeții indică capătul δ+ al legăturii.

Figura \(\PageIndex{2}\): (a) Împărtășirea inegală a perechii de electroni de legătură dintre H și Cl conduce la o sarcină pozitivă parțială pe atomul H și o sarcină negativă parțială pe Cl. Simbolurile δ+ și δ- indică polaritatea legăturii H-Cl. (b) Dipolul este reprezentat de o săgeată cu o cruce la coadă. Crucea este aproape de capătul δ+, iar vârful săgeții coincide cu δ-.
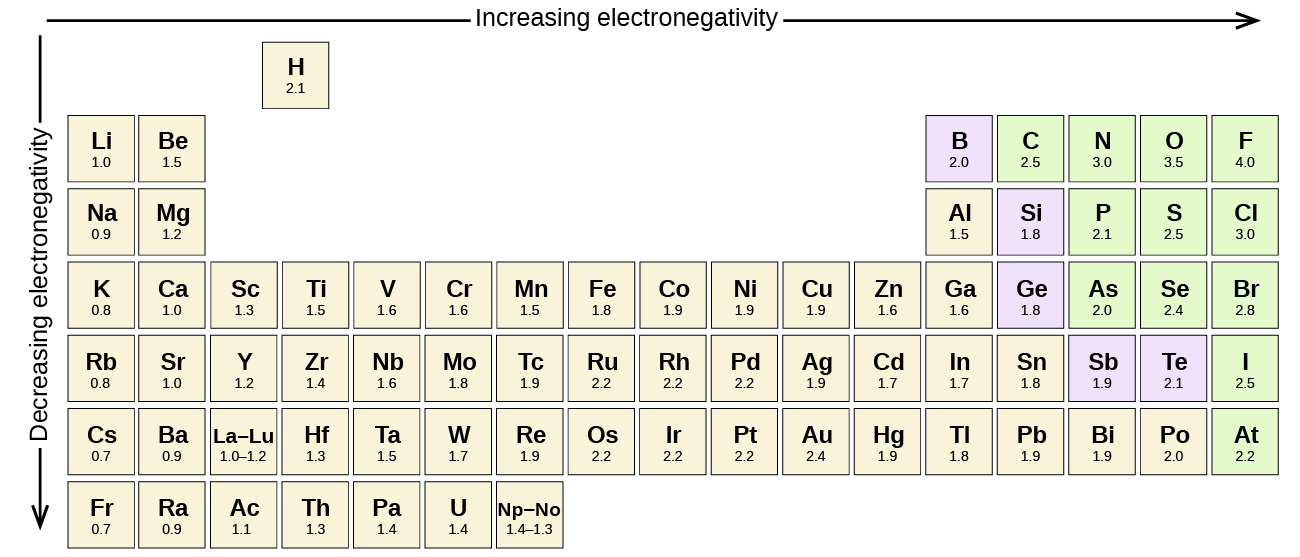
Care legătură covalentă între atomi de elemente diferite este o legătură polară, dar gradul de polaritate variază foarte mult. Unele legături între elemente diferite sunt doar puțin polare, în timp ce altele sunt puternic polare. Legăturile ionice pot fi considerate ca fiind cele mai avansate în ceea ce privește polaritatea, electronii fiind mai degrabă transferați decât împărtășiți. Pentru a judeca polaritatea relativă a unei legături covalente, chimiștii folosesc electronegativitatea, care este o măsură relativă a intensității cu care un atom atrage electronii atunci când formează o legătură covalentă. Există diferite scări numerice pentru evaluarea electronegativității. Figura \(\PageIndex{3}\) prezintă una dintre cele mai populare – scala Pauling.
Cu o privire mai atentă: Linus Pauling
Cu siguranță cel mai influent chimist al secolului XX, Linus Pauling (1901-94) este singura persoană care a câștigat două premii Nobel individuale (adică neîmpărțite). În anii 1930, Pauling a folosit noi teorii matematice pentru a enunța câteva principii fundamentale ale legăturii chimice. Cartea sa din 1939, The Nature of the Chemical Bond (Natura legăturii chimice), este una dintre cele mai importante cărți publicate vreodată în chimie.
Până în 1935, interesul lui Pauling s-a îndreptat către moleculele biologice, iar în 1954 a primit Premiul Nobel pentru Chimie pentru activitatea sa privind structura proteinelor. (A fost foarte aproape de a descoperi structura în dublă spirală a ADN-ului atunci când James Watson și James Crick au anunțat propria lor descoperire a structurii acestuia în 1953). Ulterior, a primit Premiul Nobel pentru Pace în 1962 pentru eforturile sale de a interzice testarea armelor nucleare.

Linus Pauling a fost unul dintre cei mai influenți chimiști ai secolului XX.
În ultimii săi ani, Pauling a devenit convins că doze mari de vitamina C ar putea preveni bolile, inclusiv răceala comună. Majoritatea cercetărilor clinice nu au reușit să demonstreze o legătură, dar Pauling a continuat să ia zilnic doze mari. El a murit în 1994, după ce și-a petrecut o viață întreagă stabilind o moștenire științifică pe care puțini o vor egala vreodată.
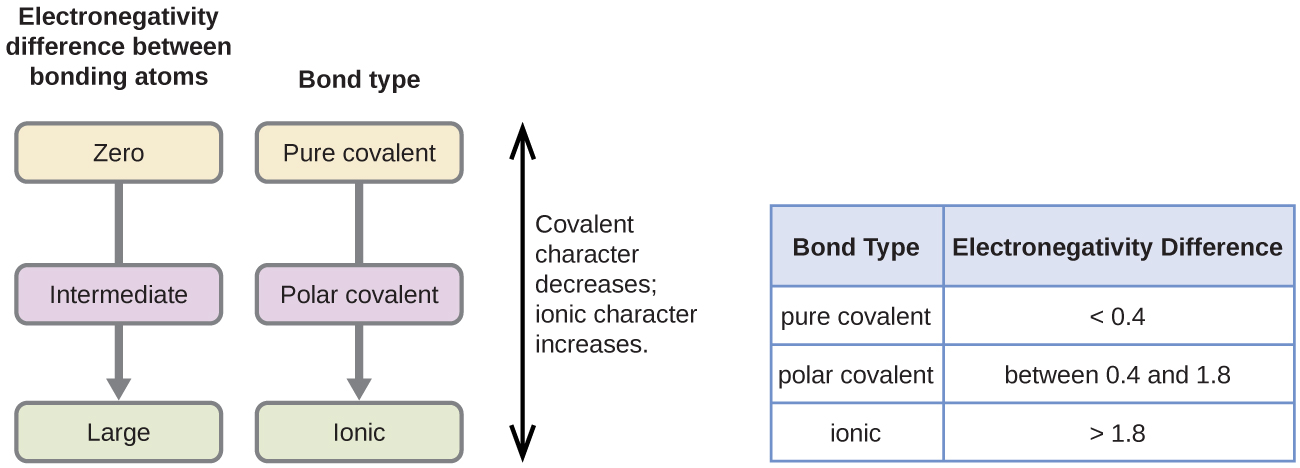
Polaritatea unei legături covalente poate fi judecată prin determinarea diferenței dintre electronegativitățile celor doi atomi care fac legătura. Cu cât este mai mare diferența de electronegativități, cu atât este mai mare dezechilibrul de partajare a electronilor în legătură. Deși nu există reguli stricte, regula generală este că, dacă diferența dintre electronegativități este mai mică de aproximativ 0,4, legătura este considerată nepolară; dacă diferența este mai mare de 0,4, legătura este considerată polară. Dacă diferența dintre electronegativități este suficient de mare (în general, mai mare de aproximativ 1,8), compusul rezultat este considerat mai degrabă ionic decât covalent. O diferență de electronegativitate de zero, desigur, indică o legătură covalentă nepolară.
Exemplu \(\PageIndex{1}})
Descrieți diferența de electronegativitate dintre fiecare pereche de atomi și polaritatea (sau tipul de legătură) rezultată.
- C și H
- H și H
- Na și Cl
- O și H
Soluție
- Carbonul are o electronegativitate de 2,5, în timp ce valoarea pentru hidrogen este de 2,1. Diferența este de 0,4, ceea ce este destul de mic. Prin urmare, legătura C-H este considerată nepolară.
- Amândoi atomii de hidrogen au aceeași valoare a electronegativității – 2,1. Diferența este zero, deci legătura este nepolară.
- Electronegativitatea sodiului este 0,9, în timp ce cea a clorului este 3,0. Diferența este de 2,1, ceea ce este destul de mare, astfel că sodiul și clorul formează un compus ionic.
- Cu 2,1 pentru hidrogen și 3,5 pentru oxigen, diferența de electronegativitate este de 1,4. Ne-am aștepta la o legătură foarte polară. The sharing of electrons between O and H is unequal with the electrons more strongly drawn towards O.
Exercise \(\PageIndex{1}\)
Describe the electronegativity (EN) difference between each pair of atoms and the resulting polarity (or bond type).
- C and O
- K and Br
- N and N
- Cs and F
Answer a:
The EN difference is 1.0 , hence polar. The sharing of electrons between C and O is unequal with the electrons more strongly drawn towards O.
Answer b:
The EN difference is greater than 1.8, hence ionic.
Answer c:
Identical atoms have zero EN difference, hence nonpolar.
Answer d:
The EN difference is greater than 1.8, hence ionic.