Introducere
Legătura ionică reprezintă transferul complet al electronului (electronilor) de valență între atomi. Este un tip de legătură chimică care generează doi ioni cu sarcină opusă. În legăturile ionice, metalul pierde electroni pentru a deveni un cation încărcat pozitiv, în timp ce nemetalul acceptă acei electroni pentru a deveni un anion încărcat negativ. Legăturile ionice necesită un donator de electroni, adesea un metal, și un acceptor de electroni, un nemetal.
Legătura ionică este observată deoarece metalele au puțini electroni în orbitalii lor cei mai externi. Prin pierderea acestor electroni, aceste metale pot obține configurația de gaz nobil și pot satisface regula octetului. În mod similar, nemetalele care au aproape 8 electroni în straturile lor de valență tind să accepte cu ușurință electroni pentru a obține configurația de gaz nobil. În legăturile ionice, mai mult de 1 electron poate fi donat sau primit pentru a satisface regula octetului. Sarcinile de pe anion și cation corespund numărului de electroni donați sau primiți. În legăturile ionice, sarcina netă a compusului trebuie să fie zero.
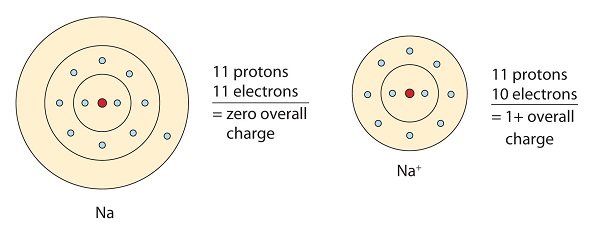
Această moleculă de sodiu donează electronul singuratic din orbitalul său de valență pentru a obține configurația octet. Aceasta creează un cation încărcat pozitiv datorită pierderii electronului.
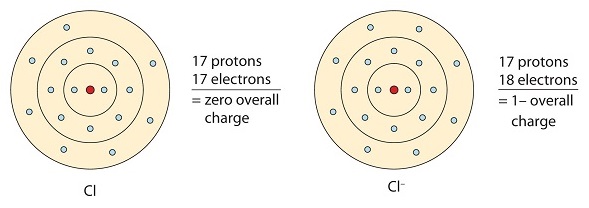
Acest atom de clor primește un electron pentru a obține configurația octet, ceea ce creează un anion încărcat negativ.
Energia globală prezisă a procesului de legătură ionică, care include energia de ionizare a metalului și afinitatea electronică a nemetalului, este de obicei pozitivă, ceea ce indică faptul că reacția este endotermică și nefavorabilă. Cu toate acestea, această reacție este foarte favorabilă din cauza atracției electrostatice dintre particule. La distanța interatomică ideală, atracția dintre aceste particule eliberează suficientă energie pentru a facilita reacția. Majoritatea compușilor ionici au tendința de a se disocia în solvenți polari, deoarece aceștia sunt adesea polari. Acest fenomen se datorează sarcinilor opuse de pe fiecare ion.
Exemplu \(\PageIndex{1}\): Sărurile de clorură
.jpg?revision=2)
În acest exemplu, atomul de sodiu donează 1 electron de valență atomului de clor. Se creează astfel un cation de sodiu și un anion de clor. Observați că sarcina netă a compusului rezultat este 0.
.jpg?revision=2)
În acest exemplu, atomul de magneziu își donează ambii electroni de valență atomilor de clor. Fiecare atom de clor poate accepta doar 1 electron înainte de a obține configurația de gaz nobil; prin urmare, sunt necesari 2 atomi de clor pentru a accepta cei 2 electroni donați de magneziu. Notice that the net charge of the compound is 0.