


Tabloul cuprinsului
Pathophysiology of SOPC
Criterii de diagnosticare
Rezistența la insulină și rezistența la leptină
Autori
Mulți dintre noi nu realizăm cât de bine funcționează sistemul complicat de bucle de feedback din sistemul nostru endocrin de reproducere până când acestea nu sunt perturbate într-un fel sau altul. Sindromul ovarelor polichistice (PCOS) reprezintă un exemplu în acest sens. Este o tulburare caracterizată de o colecție de simptome și este predominantă la pacientele care se prezintă la clinicile de infertilitate, afectând 5-10% dintre femeile aflate la vârsta reproductivă. Se estimează că 90% dintre cazurile de anovulație sunt legate de PCOS. Pe lângă faptul că afectează în mod negativ parametrii metabolici și ovulația, este, de asemenea, asociat cu mai multe probleme de sănătate mintală (cum ar fi depresia și anxietatea) la femeile care îl au. În partea 1, vom discuta despre fiziopatologia SOPC, despre criteriile de diagnosticare a acesteia și despre rezistența la insulină și leptină. În partea 2, vom aborda managementul SOPC, implicațiile psihologice și rolul unic al clinicianului în sprijinirea pacientei cu SOPC.
Pathofiziologia SOPC
La femeile ovulatorii, sub influența unei axe hipotalamo-hipofizo-ovare (HPO) care funcționează corect, ciclul menstrual este caracterizat de creșterea și dezvoltarea (de obicei) a unui singur folicul care este extras din cohorta (grupul de foliculi) din luna respectivă. Ca răspuns la stimularea GnRH, glanda pituitară anterioară secretă două gonadotropine importante: Hormonul de stimulare a foliculilor (FSH) și Hormonul luteinizant (LH). FSH acționează asupra ovarului pentru a ajuta la creșterea și maturizarea foliculilor mici. Foliculul dominant din luna respectivă este cel care a dobândit cei mai mulți receptori FSH. Acest folicul va continua să crească și să se maturizeze în detrimentul foliculilor mici rămași, care apoi sunt reabsorbiți de organism (dar sunt totuși scăzuți din rezerva totală de ovule a femeii). Creșterea foliculului dominant generează producția de estradiol, iar nivelurile ridicate de estrogen semnalează încetarea producției de FSH printr-un sistem de feedback negativ, dar un nivel ridicat și susținut de estrogen va declanșa o creștere unică de LH care determină apariția ovulației.
La o femeie cu SOPC, axa HPO nu exprimă o funcționalitate normală. Hormonul pulsatil GnRH este alterat, ceea ce determină o activitate crescută a LH de către glanda pituitară. Această creștere a LH crește stimularea celulelor theca (a se vedea Fig. 1), care produce androstendion și testosteron, doi androgeni, iar mediul hiperandrogenic rezultat al ovarului împiedică creșterea foliculară normală, maturarea și ovulația. Astfel, ovarul devine alcătuit din mulți foliculi mici, antrali, care nu devin niciodată dominanți. Colecția acestor foliculi poate provoca o creștere a dimensiunii ovarelor și poate genera un nivel seric de estrogen bazal ușor ridicat. Rămâne necunoscut de ce apare SOP și pe cine afectează, dar se crede că genetica și factorii de mediu au o interacțiune complexă în apariția și manifestările clinice ale acestuia.
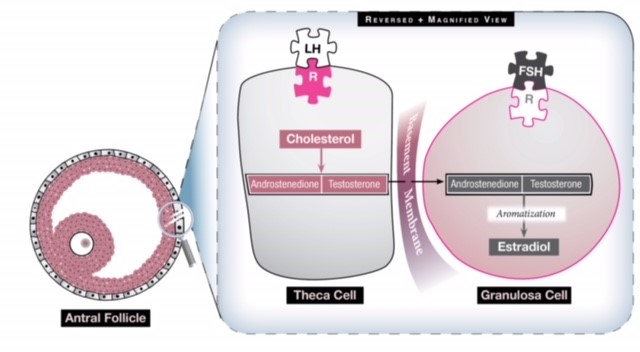
Figură 1: Există două celule în ovar care contribuie la producerea de estrogeni și care lucrează în mod sinergic. Celula theca transformă colesterolul în doi androgeni (androstendion și testosteron) sub influența LH. Acești androgeni călătoresc apoi prin membrana bazală până la celula granulosa care, sub influența FSH, îi transformă în estrogen prin intermediul unui proces numit aromatizare. Prin urmare, o stimulare excesivă cu LH va genera mai mulți androgeni decât pot fi convertiți în estrogeni, astfel încât nivelul de estrogen nu devine niciodată suficient de ridicat pentru a genera un val de LH, iar ovarul are un mediu hiperandrogenic.
Criterii de diagnostic
PCOS nu este definit sau diagnosticat de un singur simptom simplu și estede multe ori un diagnostic de excludere pentru femeile care au oligo-ovulație și dovezi de hiperandrogenism (cum ar fi acneea alopecia și hirsutismul (creștere și textură a părului cu aspect masculin), odată ce alte tulburări sunt excluse. Afectează femeile de toate formele, dimensiunile și mediile. Deși simptomele pot începe la menarhă, majoritatea clinicienilor sunt reticenți în a diagnostica o adolescentă cu menstruație relativ recentă cu SOPC, deoarece neregularitatea ciclului menstrual este normală în primul an după menarhă și se poate rezolva în timp. Criteriile de diagnostic cel mai frecvent utilizate în prezent au fost revizuite în cadrul unui atelier internațional de experți la Rotterdam, Țările de Jos, în 2003 și sunt denumite Criteriile de la Rotterdam, unde au fost stabilite următoarele: SOPC poate fi diagnosticat numai atunci când o pacientă prezintă cel puțin două din trei caracteristici: oligo/anovulație, hiperandrogenism (biochimic sau clinic) și apariția ovarelor polichistice la ecografie.Hiperandrogenismul este diagnosticat fie clinic (prin observarea de către clinician a simptomelor androgenice), fie biochimic (cum ar fi nivelurile serice ridicate ale testosteronului liber).
Aceste criterii au fost revizuite în 2018 de un comitetinternațional care a făcut câteva modificări. În primul rând, datoritădisponibilității aparatelor sensibile de ecografie transvaginală, polimorfologia ovarelor polichistice (PCOM) se caracterizează prin prezența a 20 sau mai mulți foliculi (<10 mm) în oricare dintre ovare sau un volum ovarian ≥ 10 mlîn oricare dintre ovare, așa cum se observă prin ecografie transvaginală, adesea situat în jurulperiferiei ovarului (sau ovarelor). Ghidurile din 2018 precizează, de asemenea, că, dacăo femeie are cicluri menstruale neregulate și hiperandrogenism, ecografia nu este necesară pentru diagnostic, deși mulți clinicieni preferă în continuare să o efectueze. Nivelurile hormonului antimullerian (AMH) sunt adesea ridicate la pacientele cu SOPC,deși acest lucru nu este specific SOPC, deoarece niveluri ridicate pot fi găsite la femeilefără această afecțiune. La femeile afectate de SOPC, un nivel ridicat de AMH reflectă un număr mai mare de foliculi arestați în stadiile pre-antrale și antrale care nu reușesc să ovuleze.
Alte afecțiuni care pot provoca cicluri menstruale neregulate (sarcină, hipo și hipertiroidism, insuficiență ovariană și hiperprolactinemie) și hiperandrogenism (hiperplazie congenitală suprarenală, tumoare suprarenală și tumoare secretoare de androgeni) trebuie să fie mai întâi excluse, astfel încât, pe lângă nivelurile serice de bHCG, se extrag nivelurile bazale de FSH și LH, hormonul de stimulare a tiroidei (TSH), prolactina, testosteronul total și liber, 17-hidroxiprogesteron (17OHP), sulfat de dehidroepiandrosteron (DHEAS). Unul dintre cele mai dificile diagnostice diferențiale este discernerea unei femei cu amenoree funcționalăhipotalamică (FHA) față de o femeie slabă cu SOPC. În mod clasic, femeile cu FHA au un IMC scăzut, dar acesta poate fi și în intervalul scăzut/normal. Ambele afecțiuni sunt caracterizate de anovulație și de ovare care par să aibă mulți foliculi mici în stare de repaus. Deși hiperandrogenismul nu este o componentă a FHA, femeile cu această afecțiune pot avea hirsutism din cauza etniei lor, ceea ce confundă și mai mult tabloul clinic. O modalitate de a distinge FHA de SOPC este prin analize de sânge și examinare cu ultrasunete. Femeile cu FHA au adesea niveluri bazale de FSH și LH scăzute sau normale (din cauza hipostimulării ovarelor) și un nivel scăzut de estrogen, în timp ce femeile cu SOPC au, de obicei, niveluri serice ridicate de LH și niveluri scăzute sau normale de FSH. La ecografie, uterul și ovarele femeilor cu FHA sunt mici sau mici/normale, în timp ce femeile cu SOPC au, de obicei, un volum ovarian crescut (>10 ml).Există cercetări emergente cu privire la o posibilă legătură între FHA și SOPC, deoarece nu toate femeile prezintă trăsături caracteristice ale ambelor afecțiuni, iar FHA și SOPC au unele caracteristici care se suprapun.
Rezistența la insulină și rezistența la leptină
Deși diagnosticul de rezistență la insulină (IR) nu face parte din Criteriile de la Rotterdam, acesta este foarte răspândit la femeile cu SOPC. Un IMC ridicat crește șansele ca o femeie cu SOPC să aibă IR, dar chiar și femeile care nu sunt obeze cu SOPC sunt mult mai predispuse decât omologii lor de aceeași mărime fără SOPC să dezvolte rezistență la insulină. Pe lângă consecințele pe care le are IR asupra sănătății (cum ar fi sindromul metabolic și diabetul zaharat de tip 2), aceasta exacerbează și contribuie la hiperandrogenism la o populație de pacienți care suferă deja de acesta.
Standardul de aur pentrudiagnosticarea rezistenței la insulină este utilizarea unei cleme euglicemice hiperinsulinemice, atest care trebuie efectuat într-un cadru spitalicesc. Pentru cei mai mulți, acest lucru este nerezonabil, așa că se fac teste indirecte pentru IR. La femeile cu SOPC în context clinic de preconcepție, se sugerează efectuarea unui test oral de toleranță la glucoză (OGTT), având în vedere riscul ridicat al femeilor cu SOPC de a dezvolta toleranță deficitară la glucoză și diabet gestațional în timpul sarcinii. Deși necesită mult timp, acest test este de preferat în locul glicemiei plasmatice la post și a nivelurilor de insulină, deoarece poate diagnostica toleranța deficitară la glucoză într-un stadiu mai timpuriu.La femeile cu SOPC care nu fac parte dintr-o categorie de risc ridicat (de ex, IMC<25 kg/m2, nu încearcă să conceapă, nu au antecedente personale sau familiale de toleranță deficitară la glucoză), obținerea cel puțin a nivelurilor inițiale de glucoză la jeun, insulină și hemoglobinăA1c poate fi utilă pentru a obține o „fotografie” a stării glicemice a pacientei respective.
Când o femeie are SOPC, faptul de a fi supraponderală sau obeză intensifică consecințele metabolice. Celulele albe de grăsime sunt active din punct de vedere metabolic. La un nivel normal, acestea sunt protectoare, deoarece oferă un adăpost sigur pentru lipide și țin grăsimea departe de organe. Atunci când există prea multe celule adipoase, acestea pot fi supraîncărcate și pot exploda, eliberând acizi grași în fluxul sanguin care pot afecta fiecare organ. Aceste celule grase se „blochează” între celulele din organe și fac ca acestea să fie rigide, deteriorate, mai puțin funcționale și provoacă inflamații cronice. Nu este neobișnuit să se diagnosticheze „ficatul gras” la o femeie cu SOPC care este obeză, deoarece ficatul este deosebit de vulnerabil. În plus, un exces de adipozitate poate perpetua hiperinsulinemia existentă și rezistența la insulină prin perturbarea echilibrului delicat al citokinelor și al hormonilor produși de țesutul adipos (a se vedea figura 2), de exemplu, scăzând producția de citokine care cresc sensibilitatea la insulină și crescându-le pe cele care favorizează inflamația și rezistența la insulină. Excesul de insulină contribuie și mai mult la adipozitatea abdominală și la hiperandrogenism, creând un cerc vicios la pacientele cu SOPC care poate fi dificil de depășit.
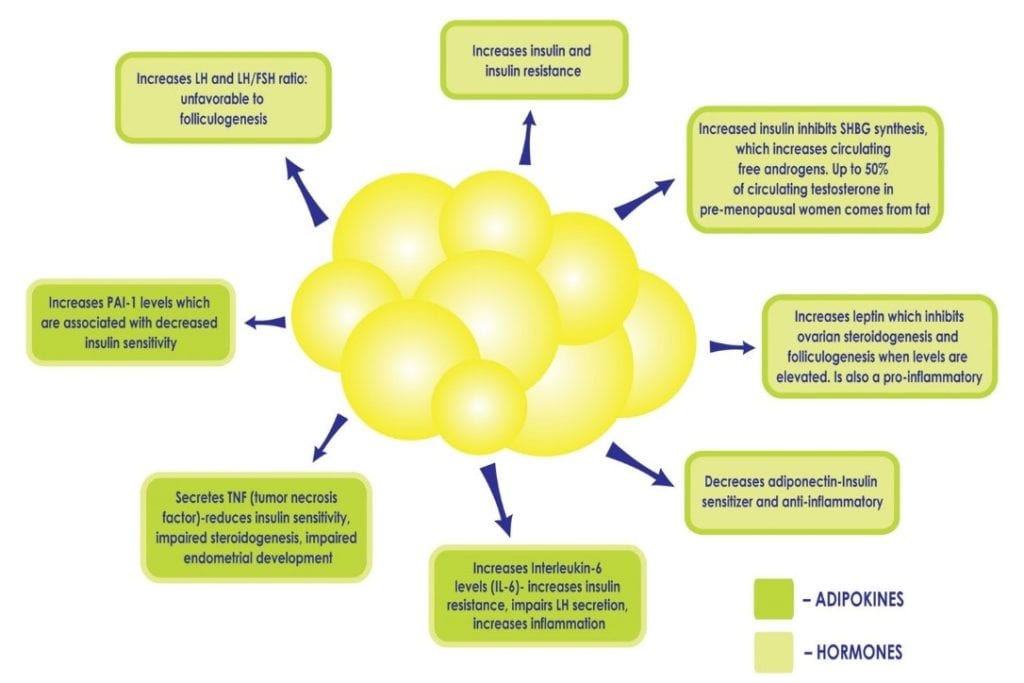
Figura 2: Creșterea adipozității și creșterea ulterioară a celulelor adipoase poate perpetua hiperinsulinemia și rezistența la insulină prin perturbarea echilibrului delicat al hormonilor produși de țesutul adipos, cum ar fi scăderea producției de adiponectină, o citokină care crește sensibilitatea la insulină și creșterea altora care favorizează inflamația.
În plus față de rezistența la insulină, pacientele cu SOPC și obezitate pot suferi și de ceea ce unii numesc rezistența la leptină. Unele studii au arătat că nivelurile de leptină sunt mai ridicate la pacienții obezi cu SOPC în comparație cu pacienții slabi. Leptina este o proteină produsă de țesutul adipos care reglează echilibrul energetic al organismului și pofta de mâncare. Atunci când funcționează corect, o creștere a leptinei semnalează creierului să reducă pofta de mâncare a unei persoane, iar o scădere a leptinei face opusul, semnalează creierului să crească pofta de mâncare pentru a furniza combustibilul necesar pentru energie. Cu toate acestea, la mulți pacienți cu SOPC cu obezitate, acest sistem este defectuos și, în ciuda concentrațiilor crescute de leptină secundare creșterii țesutului adipos, eficacitatea leptinei scade, ceea ce duce la rezistența la leptină. Rezistența la leptină este considerată un factor de risc important pentru patogeneza supraponderalității și a obezității, deoarece organismul rămâne insensibil la nivelurile ridicate și îi semnalează femeii că încă îi este foame/nu este sătulă chiar și după ce a mâncat. Multe femei cu SOPC se plâng că „nu se simt niciodată sătule” din cauza acestei rezistențe și continuă să mănânce, ceea ce duce la o creștere a țesutului adipos, ceea ce duce la o rezistență crescută la leptină și perpetuează acest ciclu dăunător. Ca urmare, condițiile de supraponderabilitate și obezitate sunt frecvente la femeile cu SOPC, iar pierderea în greutate poate părea imposibilă, deoarece alimentația intuitivă nu este eficientă atunci când semnalele de foame și sațietate nu sunt de încredere.
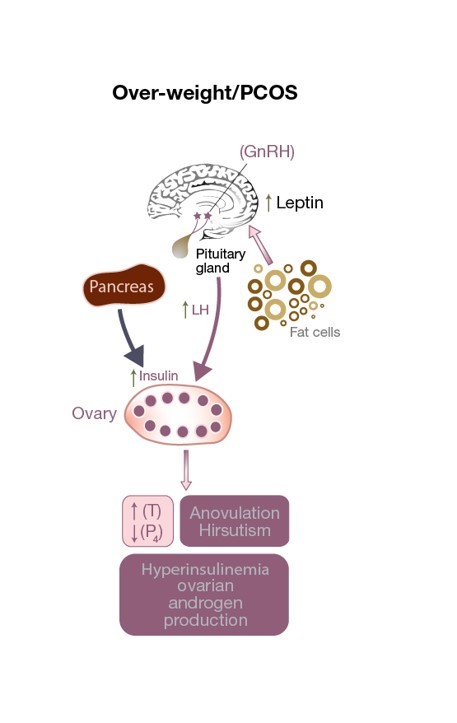
Figura 3: Perturbarea axei HPO la o pacientă cu SOPC. Există o stimulare excesivă a LH asupra celulei theca, ceea ce duce la o creștere a nivelului de testosteron, un mediu ovarian androgenic și anovulație (ceea ce duce la niveluri scăzute de progesteron). Nivelurile crescute de leptină datorate unui exces de celule adipoase afectează secreția de GnRH. Nivelurile crescute de insulină contribuie la hiperandrogenism.
Secreția deficitară de leptină nu numai căafectează greutatea corporală, dar poate avea un efect dăunător asupra ovulației (vezi Fig. 3)și chiar asupra fertilizării la pacientele cu SOPC cu greutate normală. Aceasta alterează eliberarea de GnRHdin hipotalamus, scăzând stimularea hipofizei anterioare (și, prin urmare, secreția de FSH și LH) și împiedicând dezvoltarea unui ovocit matur. În plus, granulozectelele stochează și produc leptină, iar nivelurile ridicate de leptină diminuează capacitatea lor de aromatizare, ceea ce, în cele din urmă, interferează cu capacitatea unui folicul dominant de a produce cantități adecvate de estrogen (a se vedea figura 1). Un mic studiu observațional a constatat o corelație directă între concentrația de leptină găsită în lichidul folicular (FF-leptină) (care a fost corelată cu rata de fertilizare) la femeile slabe cu SOPC care au fost supuse FIV, în comparație cu femeile cu ovulație normală, cu greutate echivalentă.
Autori
Jaclyn Carr, BSN
Brianna Giannotte, BSN
Monica Moore, MSN, RNC
Mulțumiri speciale lui NeilChappell, MD pentru ajutorul acordat la editareaacestui articol.
You can visit the FertilityNurse Newsletter website here
Want to be notified about upcoming Fertility Newsletter posts here at The ObG Project?
Get the ObG Insider e-Newsletter ”



