1. Prezentare generală a semnalizării Erk
Calea kinazei reglate de semnalul extracelular (ERK) este una dintre casetele majore de semnalizare a căii de semnalizare a proteinei kinazei activate de mitogen (MAPK). Cascada ERK este activată de o varietate de agenți extracelulari, inclusiv factori de creștere, hormoni și, de asemenea, stresuri celulare pentru a induce procese celulare care includ în principal proliferarea și diferențierea, dar în anumite condiții și răspunsul la stres și altele. Principalele componente ale MAPK/ERK kinazei (MEKK) sunt membrii familiei Raf, Raf-1, A-Raf și B-Raf, care fosforilează două reziduuri de serină pe componentele MAPK/ERK kinazei (MEK) MEK1/2. ERK1/2 sunt responsabile de stimularea efectorilor din aval, dintre care mulți sunt factori de transcripție. Unul dintre principalii factori de transcripție este proteina de legare a elementelor de răspuns la AMP ciclic (CREB).
Această cale ERK contribuie la controlul unui număr mare de procese celulare:
– Reglarea proliferării celulare, cum ar fi activarea celulelor T
– Plasticitatea sinaptică, cum ar fi plasticitatea sinaptică de lungă durată.potențarea pe termen lung (LTP) în neuronii hipocampali
– Proliferarea celulelor endoteliale în timpul angiogenezei
– Fosforilarea factorului de transcripție p53
– Remodelarea căii de semnalizare ERK poate contribui la dezvoltarea bolii polichistice a rinichilor
– Activarea fosfolipazei A2 (PLA2) în mastocite.
2. Cascada de semnalizare Erk
Activarea cascadei ERK1/2 este inițiată în cea mai mare parte la receptorii membranari, cum ar fi receptorii Tyr kinazei (RTK), receptorii cuplați cu proteina G (GPCR), canalele ionice și altele. Acești receptori transmit semnalul prin recrutarea unor proteine adaptoare (de exemplu, Grb2) și a unor factori de schimb (de exemplu, SOS) care, la rândul lor, induc activarea lui Ras la nivelul membranelor plasmatice sau al membranelor altor organite. Ras activat, legat de GTP, transmite apoi semnalul prin activarea protein-kinazelor Raf-1, B-Raf și A-Raf (Rafs) în cadrul nivelului MAP3K al acestei cascade. Această activare are loc prin recrutarea Rafs la membrane, unde acestea sunt apoi fosforilate și activate. MOS este un alt MAP3K din cascada ERK, dar funcționează în principal în sistemul reproducător printr-un mod de reglare distinct. De la nivelul MAP3K, semnalul este apoi transmis în josul cascadei prin componentele MAPKK: MEK1/2. Acestea sunt activate prin fosforilarea serinei la nivelul motivului Ser-Xaa-Ala-Xaa-Ser/Thr tipic MAPKK din bucla lor de activare. La rândul lor, MEK1/2 activează singurii lor substraturi cunoscuți, ERK1/2 nativi, care funcționează ca singurele lor ținte în aval, ceea ce sugerează că MEK1/2 servesc drept componente ale cascadei ERK1/2 care determină specificitatea. MEK1/2 sunt singurele proteine kinaze cu dublă specificitate care pot fosforila atât reziduurile Thr, cât și Tyr de reglementare ale ERK1/2. Până în prezent, au fost identificate aproximativ 200 de substraturi distincte ale ERK1/2. Acestea sunt substraturi fie în citosol (de exemplu, PLA2 RSK), fie, în urma translocării, în nucleu, inclusiv factori de transcripție precum Elk1, c-Fos și c-Jun.
– MAP3K-Raf 1
Raf-1 este cea mai bine studiată dintre moleculele de semnalizare a factorilor de creștere la nivelul MAP3K din cascadă. Este o proteină serin/treonin-kinază de 70 până la 75 kDa, care conține un domeniu kinazic în jumătatea COOH-terminală a moleculei și un domeniu reglator care ocupă restul. La stimularea cu diverși mitogeni, Raf-1 suferă o activare tranzitorie în 2-3 mm. Mecanismul de activare a Raf-1 a fost studiat pe larg în ultimii ani. În prezent, este clar că Raf-1 se află în aval de HAS, care pare să interacționeze direct cu porțiunea NH2-terminală a Raf-1 la stimulare.
– MAPKK-MEK1/2
MEK-urile constituie o familie conservată din punct de vedere evolutiv de proteine serină/treonină kinaze care, până în prezent, include trei izoforme de mamifere foarte omologe (85%). Mecanismul de activare a MEK-1 implică fosforilarea proteinei numai pe reziduuri de serină și pare să fie similar indiferent dacă este fosforilată de MEKK, Raf-1 sau prin autofosforilare, după cum se determină prin hărți fosfopeptidice. MAPKK-urile (MEK-urile) sunt foarte specifice pentru componentele din aval ERK-1 și ERK-2. Mai mult, MAPKK nu a reușit să recunoască nici forma denaturată a substratului său, nici peptidele care conțin situsurile de fosforilare din ERK, ceea ce indică faptul că enzima are nevoie de forma nativă a MAPK.
– MAPK-ERK-1/2
Din cauza gradului lor ridicat de similaritate, ERK-1 și ERK-2 sunt considerate de obicei ca fiind redundante din punct de vedere funcțional. Principalul mecanism în amonte care conduce la fosforilarea ERK-1 și -2 pe ambele reziduuri de reglare este fosforilarea lor de către MEK. Din cauza naturii destul de largi a recunoașterii substratului său, ERK-urile pot fosforila un număr mare de proteine după activarea lor. Aceste proteine sunt adesea de natură reglatoare și sunt localizate atât în citoplasmă, cât și în nucleu.
3. Semnalizarea în aval a căii Erk
– Proliferarea celulară
ERK1/2 activată fosforilează RSK și atât RSK, cât și ERK se translocă în nucleu, unde activează mai mulți factori de transcripție, cum ar fi CREB, Fos și Elk-1, rezultând în cele din urmă în sinteza de proteine efectoare și provocând modificări în proliferarea și supraviețuirea celulelor. CREB (cAMP response element-binding protein) este un factor de transcripție celulară care poate intensifica transcrierea genelor de peste 10 ori. c-fos este o proteină de 380 de aminoacizi cu o regiune de bază cu fermoar de leucină pentru dimerizare și legare la ADN și un domeniu de transactivare la extremitatea C-terminală. Este implicată în evenimente celulare importante, inclusiv în proliferarea, diferențierea și supraviețuirea celulelor; proteina care conține domeniul ETS (Elk-1) este o proteină care la om este codificată de gena ELK1. Funcția Elk-1 este, de asemenea, aceea de activator de transcripție.
– Oncogeneza
Activarea ELK1/2 promovează metaplazia și dezvoltarea tumorală prin fosforilarea Bim și Bid și provocând degradarea proteazomului Bim și sechestrarea lui Bad la proteinele de legare a fosfoserinei și, astfel, inhibarea apoptozei. Pe o cale separată, activarea ERK1/2 fosforilează FOXO3a la Ser 294, Ser 344 și Ser 425 și facilitează interacțiunea FOXO3a-MDM2. Această interacțiune îmbunătățește degradarea FOXO3a printr-o cale ubiquitin-proteazomică dependentă de MDM2, ceea ce duce la dezvoltarea tumorală.
– Dezvoltare și diferențiere
Semnalizarea de către receptorii tirozin-kinazici care activează calea Ras/Raf/MAP kinazei reglează dezvoltarea și diferențierea multor tipuri de celule. În principal prin activarea transducătorilor de semnal și a activatorilor proteinelor de transcripție (STAT).
– Ciclul celular
Cdc25 activează kinazele dependente de ciclină prin îndepărtarea fosfatului din reziduurile din situsul activ al Cdk. Se știe că controlează tranzițiile de la G1 la faza S și de la G2 la faza M. Erk1/2 poate activa proteina Cdc25 și, la rândul său, poate promova progresia ciclului celular.
4. Reglarea semnalizării Erk
Reglarea semnalizării Erk este foarte importantă pentru noi pentru a menține funcția normală a celulelor. Există mai multe strategii de reglare pentru ca celula să reglementeze calea de semnalizare Erk, care includ, în principal, reglarea prin bucle de feedback, prin schele de sus și de jos, prin fosfatază și inhibitori ai căii de semnalizare Erk.
– Reglarea buclelor de feedback
Există mai multe puncte de feedback negativ în calea ERK (figura 1). MEK este una dintre ținte și poate fi inhibată prin fosforilarea ERK a MEK1/2 la Thr292 și Thr212. Fosforilarea împiedică intensificarea ulterioară a activității MEK de către PAK1 și, prin urmare, reduce activarea ERK. Fosforilarea lui Raf în mai multe locuri de către ERK oferă un al doilea mecanism posibil de buclă de reacție. Hiperfosforilarea acestor situsuri împiedică interacțiunea Raf cu Ras GTPază și promovează defosforilarea sa de către fosfataza PP2A. Activarea sau amplificarea transcripțională a fosfatazelor de către ERK reprezintă un mecanism alternativ de feedback negativ. Aceste diverse bucle de reacție negativă activate de ERK oferă un mijloc de limitare a duratei semnalului și de readucere a căii la starea bazală.
– Reglarea scheletelor ascendente și descendente
Proteinele schelet se leagă de două sau mai multe componente ale unei căi de semnalizare pentru a le aduce în imediata apropiere și a facilita astfel interacțiunea lor funcțională. În plus, schelele pot direcționa aceste module de semnalizare multienzimatice către diferite locații celulare și, astfel, pot spori fosforilarea unui subset specific de substraturi down-stream. Schelele influențează, de asemenea, durata semnalului, previn diafonia între căi similare și pot lega activarea modulului de semnalizare de un semnal activator specific din amonte.
– Fosfataze și inhibitori
Activitatea căilor MAPK este determinată de acțiunile concurente ale kinazelor din amonte și ale fosfatazelor inhibitoare. Căile MAPK sunt terminate prin defosforilarea componentelor lor de către mai multe fosfataze. S-a demonstrat că mai multe serină/treonină fosfataze, cum ar fi PP2A și PP2Ca, și tirozine fosfataze, cum ar fi PTP-SL și HePTP, inactivează MAPK-urile.
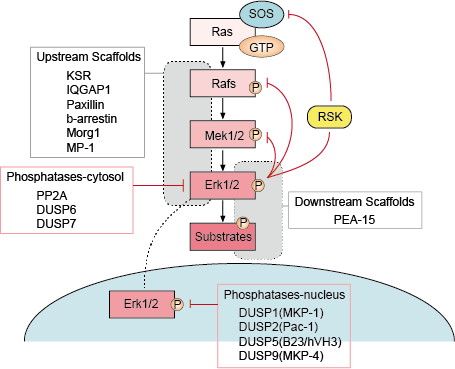
Figura 1. Reglarea căii de semnalizare a lui Erk
5. Relația cu bolile
În concordanță cu rolurile lor critice în activități celulare cheie, inclusiv proliferarea, diferențierea și supraviețuirea sau moartea celulelor, căile de semnalizare MAPK au fost implicate în patogeneza multor boli umane.
– Boala Alzheimer
Boala Alzheimer (AD) este o boală neurodegenerativă caracterizată prin disfuncții cognitive și de memorie despre care se crede că rezultă din formarea în creier atât a plăcilor senile care conțin amiloid-β (Aβ), cât și a încurcăturilor neurofibrilare care conțin proteina tau asociată microtubulilor. Astfel, dovezile sugerează că căile de semnalizare MAPK pot contribui la patogeneza bolii Alzheimer prin reglarea apoptozei neuronale, a activității β- și γ-secretazei și a fosforilării APP și tau.
– Boala Parkinson
Boala Parkinson (PD) este a doua cea mai răspândită boală neurodegenerativă. Diverse observații sugerează că că căile de semnalizare MAPK contribuie la răspunsurile neuroinflamatorii și la moartea neuronală declanșate de agregatele de α-sinucleină sau de deficiențele funcționale ale parkin sau DJ-1 în patogeneza bolii Parkinson.
– Semnalizarea MAPK în cancer
Multe dintre mutațiile asociate cancerului ale componentelor căilor de semnalizare MAPK au fost găsite în Ras și B-Raf, ambele participând la calea de semnalizare ERK. Calea de semnalizare ERK joacă un rol în mai multe etape ale dezvoltării tumorilor. Fosforilarea de către ERK a unor proteine precum kinaza lanțului ușor de miozină, calpaina, kinaza de adeziune focală și paxilina promovează migrația celulelor canceroase. În plus, semnalizarea ERK1/2 reglează activitățile și nivelurile proteinelor din familia Bcl-2, cum ar fi proteina proapoptotică BIM și proteina antiapoptotică MCL-1, promovând astfel supraviețuirea celulelor canceroase.
| Keshet Y, Seger R. The MAP kinase signaling cascades: a system of hundreds of components regulates a diverse array of physiological functions. MAP Kinase Signaling Protocols: Second Edition, 2010: 3-38. | |
| Wortzel I, Seger R. The ERK cascade distinct functions within various subcellular organelles. Genes & cancer, 2011, 2(3): 195-209. | |
| Ramos J W. The regulation of extracellular signal-regulated kinase (ERK) in mammalian cells. The international journal of biochemistry & cell biology, 2008, 40(12): 2707-2719. | |
| Shaul Y D, Seger R. The MEK/ERK cascade: from signaling specificity to diverse functions. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2007, 1773(8): 1213-1226. | |
| Yao Z, Seger R. The ERK signaling cascade—views from different subcellular compartments. Biofactors, 2009, 35(5): 407-416. |