Formální náboje
Organické molekuly mohou mít také kladné nebo záporné náboje. Během chemických reakcí se běžně vyskytují náboje reaktantů, meziproduktů a/nebo produktů. Rozpoznávání a rozlišování neutrálních a nabitých vazebných vzorců bude užitečné při studiu reakčních mechanismů. Uvažujte Lewisovu strukturu methanolu, CH3OH (methanol je takzvaný „dřevný alkohol“, který bezohlední pašeráci někdy prodávali v době prohibice ve 20. letech 20. století, což často způsobovalo oslepnutí lidí, kteří jej pili). Methanol sám o sobě je neutrální molekula, ale může ztratit proton a stát se molekulárním aniontem (CH3O-) nebo získat proton a stát se molekulárním kationtem (CH3OH2+).

Molekulární aniont a kationt mají celkový náboj -1, resp. +1. Můžeme však být konkrétnější – u každého molekulárního iontu můžeme také uvést, že formální náboj se nachází konkrétně na atomu kyslíku, nikoli na atomu uhlíku nebo některém z atomů vodíku.
Zjistit formální náboj na různých atomech molekuly je jednoduchý proces – jde jednoduše o sečtení valenčních elektronů.
Nevázaný atom kyslíku má 6 valenčních elektronů. Pokud je však vázán jako součást molekuly metanolu, je atom kyslíku obklopen 8 valenčními elektrony: 4 nevazebnými elektrony (dva „osamělé páry“) a 2 elektrony v každé ze dvou kovalentních vazeb (jeden k uhlíku, jeden k vodíku). Podle konvence formálního náboje říkáme, že kyslík „vlastní“ všechny 4 nevazebné elektrony. Vlastní však pouze jeden elektron z každé ze dvou kovalentních vazeb, protože kovalentní vazby zahrnují sdílení elektronů mezi atomy. Proto atom kyslíku v metanolu vlastní 2 + 2 + (½ x 4) = 6 valenčních elektronů.
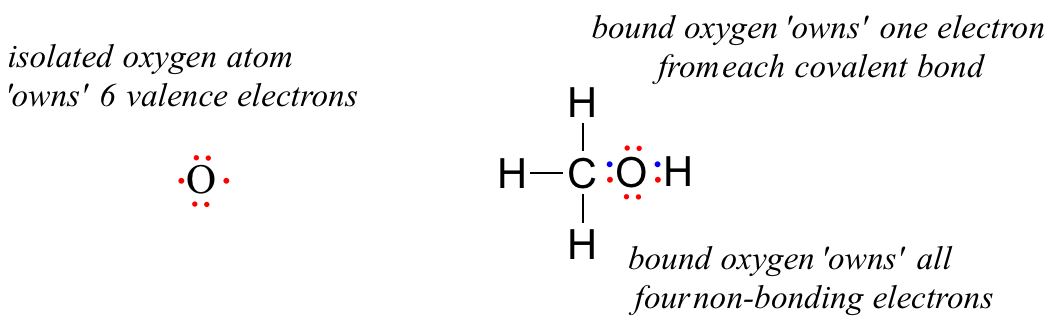
The formal charge on an atom is calculated as the number of valence electrons owned by the isolated atom minus the number of valence electrons owned by the bound atom in the molecule:
Determining formal charge on an atom
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of valence electrons owned by the bound atom)
or . . .
formal charge =
(number of valence electrons owned by the isolated atom)
– (number of non-bonding electrons on the bound atom)
– ( ½ the number of bonding electrons on the bound atom)
Using this formula for the oxygen atom of methanol, we have:
formal charge on oxygen =
(6 valence electrons on isolated atom)
– (4 non-bonding electrons)
– (½ x 4 bonding electrons)
= 6 – 4 – 2 = 0. Thus, oxygen in methanol has a formal charge of zero (in other words, it has no formal charge).
How about the carbon atom in methanol? An isolated carbon owns 4 valence electrons. The bound carbon in methanol owns (½ x 8) = 4 valence electrons:
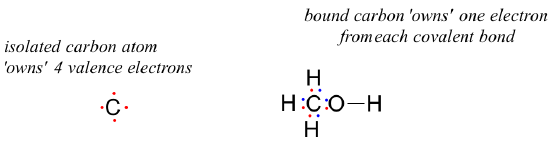
formal charge on carbon =
(4 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 8 bonding electrons)
= 4 – 0 – 4 = 0. So the formal charge on carbon is zero.
For each of the hydrogens in methanol, we also get a formal charge of zero:
formal charge on hydrogen =
(1 valence electron on isolated atom)
– (0 nonbonding electrons)
– (½ x 2 bonding electrons)
= 1 – 0 – 1 = 0
Now, let’s look at the cationic form of methanol, CH3OH2+. The bonding picture has not changed for carbon or for any of the hydrogen atoms, so we will focus on the oxygen atom.
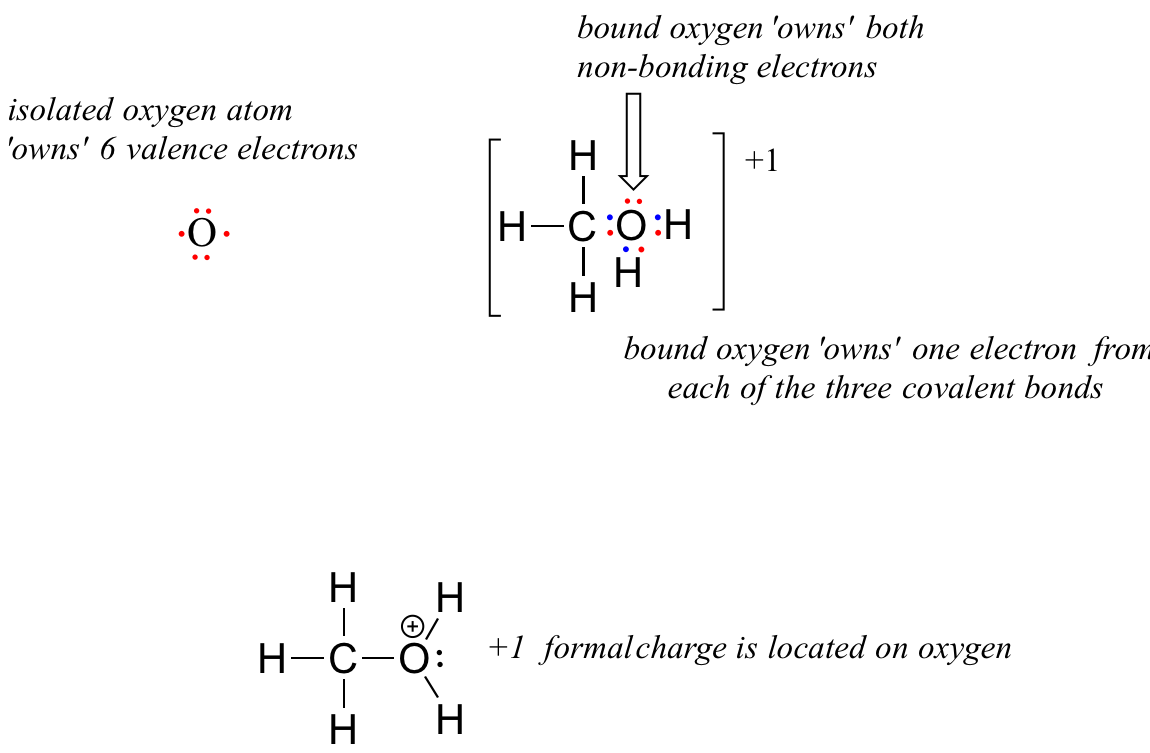
The oxygen owns 2 non-bonding electrons and 3 bonding elections, so the formal charge calculations becomes:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (2 non-bonding electrons)
– (½ x 6 bonding electrons)
= 6 – 2 – 3 = 1. A formal charge of +1 is located on the oxygen atom.
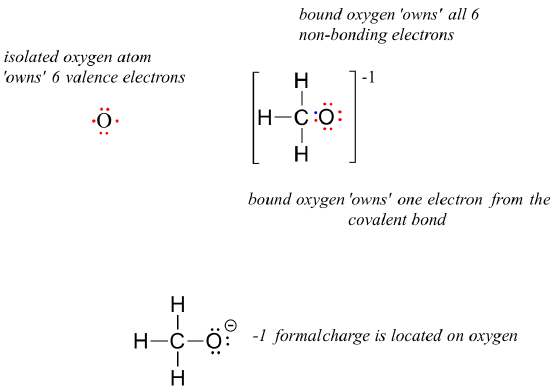
For methoxide, the anionic form of methanol, the calculation for the oxygen atom is:
formal charge on oxygen =
(6 valence electrons in isolated atom)
– (6 non-bonding electrons)
– (½ x 2 bonding electrons)
= 6 – 6 – 1 = -1. A formal charge of -1 is located on the oxygen atom.
A very important rule to keep in mind is that the sum of the formal charges on all atoms of a molecule must equal the net charge on the whole molecule.
Při kreslení struktur organických molekul je velmi důležité zobrazit všechny nenulové formální náboje a mít jasno v tom, kde se náboje nacházejí. Struktura, ve které chybí nenulové formální náboje, není nakreslena správně a pravděpodobně bude takto při zkoušce označena!
Při vzpomínce na to, co jste se učili v obecné chemii, se v tuto chvíli pravděpodobně ptáte: „A co dipóly? Copak atom kyslíku ve vazbě O-H „nevlastní“ větší část elektronové hustoty než vodík, protože má větší elektronegativitu?“ „Ne. To je naprosto správné a my si pojem vazebných dipólů probereme později. Pro účely výpočtu formálních nábojů však na vazebných dipólech nezáleží – vždy považujeme oba elektrony ve vazbě za rovnoměrně sdílené, i když to není přesný odraz chemické reality. Formální náboje jsou jen formalitou, metodou evidence elektronů, která je spojena s Lewisovým systémem pro kreslení struktur organických sloučenin a iontů. Později uvidíme, jak nám pojem formálního náboje může pomoci představit si, jak organické molekuly reagují.
Nakonec se nenechte svést k myšlence, že jen proto, že čistý náboj struktury je nulový, neexistují žádné atomy s formálním nábojem: jeden atom může mít kladný formální náboj a jiný záporný formální náboj, a čistý náboj bude stále nulový. Zwitteriony, jako jsou aminokyseliny, mají kladné i záporné formální náboje na různých atomech:

I když je čistý náboj glycinu nulový, je přesto nutné zobrazit umístění kladných a záporných formálních nábojů.
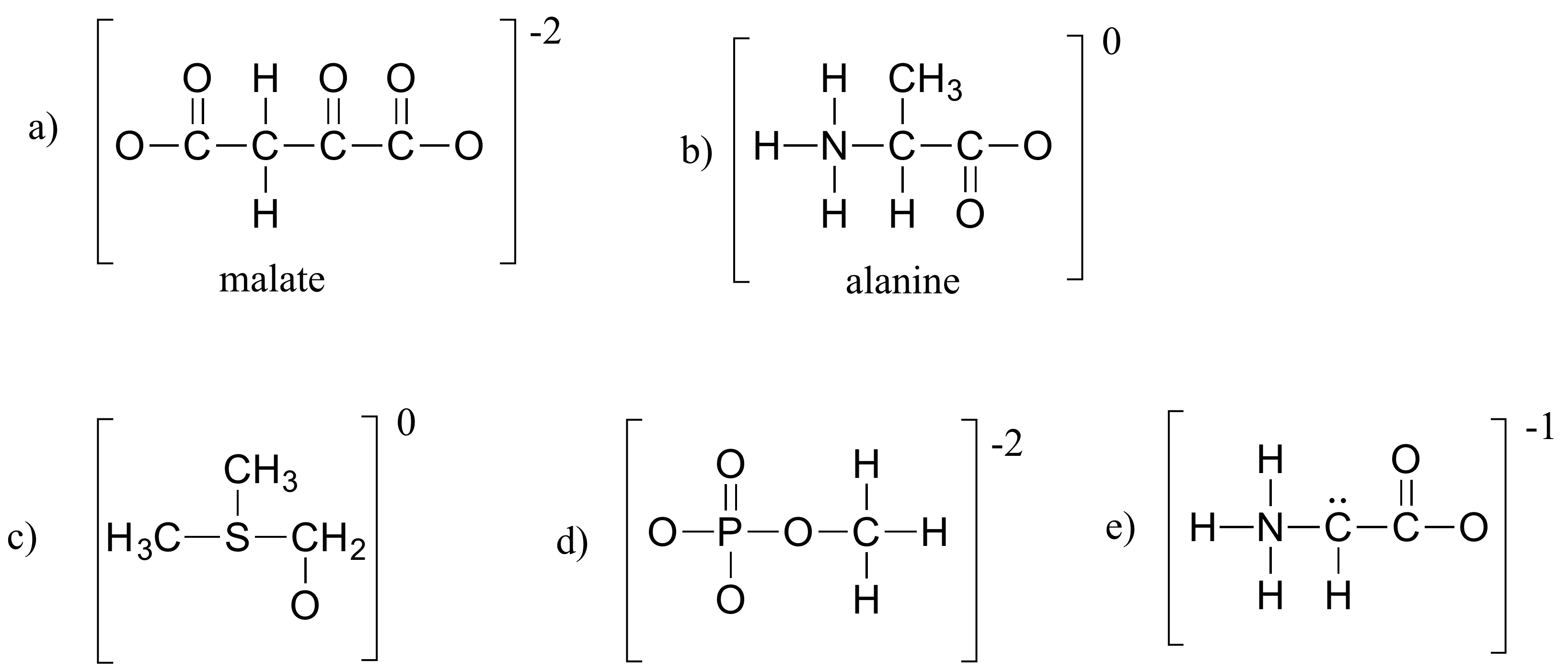
Cvičení 1.4
Doplňte všechny chybějící elektrony osamělých párů a formální náboje v níže uvedených strukturách. Předpokládejte, že všechny atomy mají úplnou valenční slupku elektronů. Čisté náboje jsou uvedeny mimo závorky.
Řešení cvičení
.