Elektronegativita a polarita vazby
Ačkoli jsme kovalentní vazbu definovali jako sdílení elektronů, elektrony v kovalentní vazbě nejsou vždy sdíleny oběma vázanými atomy rovnoměrně. Pokud vazba nespojuje dva atomy stejného prvku, jako je tomu u H2, bude vždy existovat jeden atom, který přitahuje elektrony ve vazbě silněji než druhý atom, jako je tomu u HCl, znázorněné na obrázku \(\PageIndex{1}\). Kovalentní vazba, která má rovnoměrné sdílení elektronů (obrázek \(\PageIndex{1a}\)), se nazývá nepolární kovalentní vazba. Kovalentní vazba, která má nerovnoměrné sdílení elektronů, jako na obrázku \(\PageIndex{1b}\), se nazývá polární kovalentní vazba.

Rozložení elektronové hustoty v polární vazbě je nerovnoměrné. Je větší kolem atomu, který přitahuje elektrony více než druhý. Například elektrony ve vazbě H-Cl v molekule chlorovodíku tráví více času v blízkosti atomu chloru než v blízkosti atomu vodíku. Všimněte si, že stínovaná oblast kolem Cl na obrázku \(\PageIndex{1b}\) je mnohem větší než kolem H.
Tato nerovnováha v elektronové hustotě vede k nahromadění částečného záporného náboje (označovaného jako δ-) na jedné straně vazby (Cl) a částečného kladného náboje (označovaného jako δ+) na druhé straně vazby (H). To je vidět na obrázku \(\PageIndex{2a}\). Oddělení náboje v polární kovalentní vazbě vede k elektrickému dipólu (dva póly), který je znázorněn šipkou na obrázku \(\PageIndex{2b}\). Směr šipky směřuje k δ- konci, zatímco + ocas šipky označuje δ+ konec vazby.
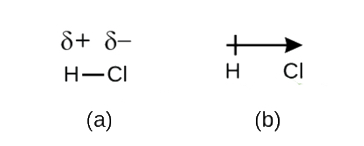
Obrázek \(\PageIndex{2}\): (a) Nerovné sdílení vazebného páru elektronů mezi H a Cl vede k částečnému kladnému náboji na atomu H a částečnému zápornému náboji na Cl. Symboly δ+ a δ- označují polaritu vazby H-Cl. (b) Dipól je znázorněn šipkou s křížkem na konci. Křížek je u konce δ+ a hrot šipky se shoduje s δ-.
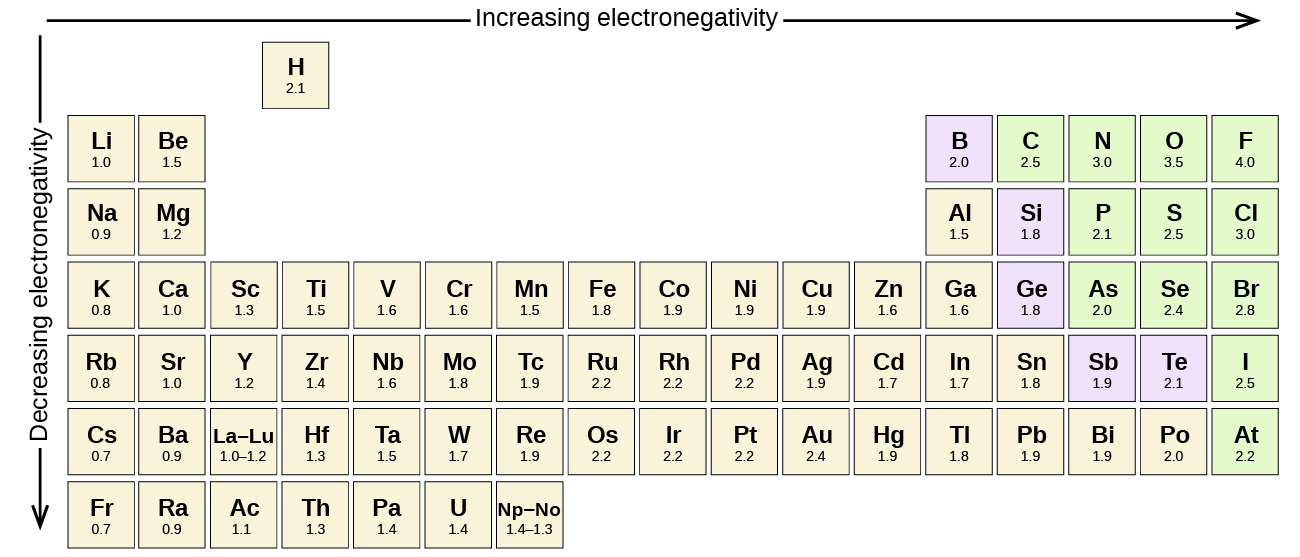
Každá kovalentní vazba mezi atomy různých prvků je polární vazbou, ale stupeň polarity se značně liší. Některé vazby mezi různými prvky jsou jen minimálně polární, zatímco jiné jsou silně polární. Za vrchol polarity lze považovat iontové vazby, ve kterých se elektrony spíše přenášejí než sdílejí. K posouzení relativní polarity kovalentní vazby používají chemici elektronegativitu, což je relativní míra toho, jak silně atom přitahuje elektrony, když tvoří kovalentní vazbu. Pro hodnocení elektronegativity existují různé číselné stupnice. Obrázek \(\PageIndex{3}\) ukazuje jednu z nejoblíbenějších stupnic – Paulingovu stupnici.
Pohled zblízka: Linus Pauling
Linus Pauling (1901-94), pravděpodobně nejvlivnější chemik 20. století, je jedinou osobou, která získala dvě individuální (tj. nedělené) Nobelovy ceny. Ve 30. letech 20. století Pauling použil nové matematické teorie k vyslovení některých základních principů chemické vazby. Jeho kniha The Nature of the Chemical Bond z roku 1939 je jednou z nejvýznamnějších knih, které kdy byly v chemii publikovány.
V roce 1935 se Paulingův zájem obrátil k biologickým molekulám a v roce 1954 mu byla udělena Nobelova cena za chemii za práci o struktuře bílkovin. (Byl velmi blízko objevu struktury dvojité šroubovice DNA, když James Watson a James Crick v roce 1953 oznámili vlastní objev její struktury). Později mu byla v roce 1962 udělena Nobelova cena za mír za jeho úsilí o zákaz testování jaderných zbraní.

Linus Pauling byl jedním z nejvlivnějších chemiků 20. století.
V pozdějších letech byl Pauling přesvědčen, že velké dávky vitaminu C zabrání nemocem, včetně nachlazení. Většina klinických výzkumů souvislost neprokázala, Pauling však nadále užíval velké dávky denně. Zemřel v roce 1994 a po celém svém životě vytvořil vědecké dědictví, kterému se jen málokdo vyrovná.
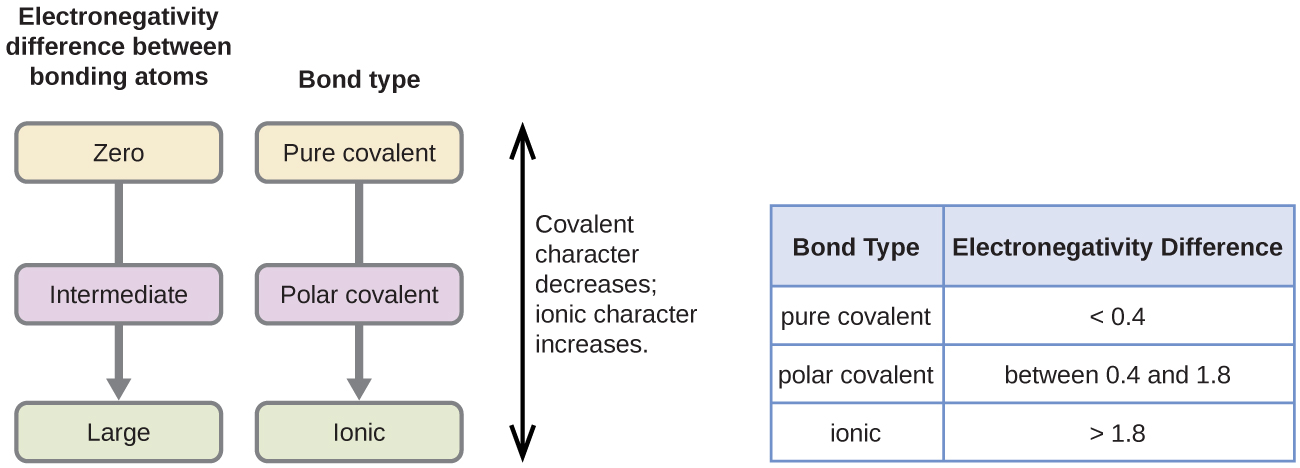
Polaritu kovalentní vazby lze posoudit na základě rozdílu elektronegativit dvou atomů tvořících vazbu. Čím větší je rozdíl elektronegativit, tím větší je nerovnováha sdílení elektronů ve vazbě. Ačkoli neexistují žádná pevná pravidla, obecně platí, že pokud je rozdíl elektronegativit menší než přibližně 0,4, je vazba považována za nepolární; pokud je rozdíl větší než 0,4, je vazba považována za polární. Pokud je rozdíl elektronegativit dostatečně velký (obecně větší než asi 1,8), výsledná sloučenina se považuje spíše za iontovou než kovalentní. Nulový rozdíl elektronegativit samozřejmě znamená nepolární kovalentní vazbu.
Příklad \(\PageIndex{1}\)
Popište rozdíl elektronegativit mezi jednotlivými dvojicemi atomů a výslednou polaritu (nebo typ vazby).
- C a H
- H a H
- Na a Cl
- O a H
Řešení
- Uhlík má elektronegativitu 2,5, zatímco hodnota pro vodík je 2,1. Uhlík má elektronegativitu 2,5, zatímco vodík má elektronegativitu 2,1.
- Uhlík má elektronegativitu 2,5, zatímco vodík má elektronegativitu 2,1. Rozdíl činí 0,4, což je poměrně málo. Vazba C-H je proto považována za nepolární.
- Oba atomy vodíku mají stejnou hodnotu elektronegativity – 2,1. Vazba C-H je proto považována za nepolární. Rozdíl je nulový, vazba je tedy nepolární.
- Elektronegativita sodíku je 0,9, zatímco elektronegativita chloru je 3,0. Vazba je tedy nepolární. Rozdíl je 2,1, což je poměrně vysoká hodnota, a proto sodík a chlor tvoří iontovou sloučeninu.
- Při hodnotě 2,1 pro vodík a 3,5 pro kyslík je rozdíl elektronegativit 1,4. V případě vodíku je rozdíl elektronegativit 1,4, což je poměrně vysoká hodnota. Očekávali bychom tedy velmi polární vazbu. The sharing of electrons between O and H is unequal with the electrons more strongly drawn towards O.
Exercise \(\PageIndex{1}\)
Describe the electronegativity (EN) difference between each pair of atoms and the resulting polarity (or bond type).
- C and O
- K and Br
- N and N
- Cs and F
Answer a:
The EN difference is 1.0 , hence polar. The sharing of electrons between C and O is unequal with the electrons more strongly drawn towards O.
Answer b:
The EN difference is greater than 1.8, hence ionic.
Answer c:
Identical atoms have zero EN difference, hence nonpolar.
Answer d:
The EN difference is greater than 1.8, hence ionic.