Dosage Form: powder for oral suspension
Medically reviewed by Drugs.com. Last updated on April 1, 2019.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
- INDICATIONS & USAGE
- Respiratory Tract Infections
- Otitis Media
- Infekce kůže a kožních struktur
- Infekce kostí
- Infekce močových cest
- Použití
- DÁVKOVÁNÍ & PODÁVÁNÍ
- Dospělí a dětští pacienti ve věku nejméně 15 let
- Pediatričtí pacienti (starší 1 roku)
- Úpravy dávkování u dospělých a dětských pacientů ve věku nejméně 15 let s poruchou funkce ledvin
- DÁVKOVACÍ FORMY & SILY
- Kontraindikace
- Upozornění a opatření
- Reakce z přecitlivělosti
- Průjmy spojené s Clostridium difficile
- Přímá sérokonverze Coombsova testu
- Potenciál záchvatů
- Prodloužený protrombinový čas
- Vývoj bakterií rezistentních na léky
- Nežádoucí účinky
- Zkušenosti z klinických studií
- Lékové interakce
- Metformin
- Probenecid
- Interakce s laboratorními nebo diagnostickými testy
- Použití u specifických populací
- Těhotenství
- Kojící matky
- Pediatrické použití
- Geriatrické použití
- Poškození funkce ledvin
- Předávkování
- Popis přípravku Cefalexin suspenze
- Cephalexin suspenze – klinická farmakologie
- Mechanismus účinku
- Farmakokinetika
- Mikrobiologie
- Nonclinical Toxicology
- Carcinogenesis & Mutagenesis & Impairment Of Fertility
- How Supplied/Storage and Handling
- Informace pro pacienty
- Frequently asked questions
- More about cephalexin
- Consumer resources
- Professional resources
- Related treatment guides
INDICATIONS & USAGE
Respiratory Tract Infections
Cephalexin is indicated for the treatment of respiratory tract infections caused by susceptible isolates of Streptococcus pneumoniae and Streptococcus pyogenes.
Otitis Media
Cephalexin is indicated for the treatment of otitis media caused by susceptible isolates of Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus, Streptococcus pyogenes, and Moraxella catarrhalis.
Infekce kůže a kožních struktur
Cephalexin je indikován k léčbě infekcí kůže a kožních struktur způsobených citlivými izoláty následujících grampozitivních bakterií:
Infekce kostí
Cephalexin je indikován k léčbě infekcí kostí způsobených citlivými izoláty Staphylococcus aureus a Proteus mirabilis.
Infekce močových cest
Cephalexin je indikován k léčbě infekcí močových cest, včetně akutní prostatitidy, způsobených citlivými izoláty Escherichia coli, Proteus mirabilis a Klebsiella pneumoniae.
Použití
Aby se omezil rozvoj bakterií rezistentních na léky a zachovala se účinnost cefalexinu a dalších antibakteriálních léčiv, měl by se cefalexin používat pouze k léčbě infekcí, u kterých je prokázáno nebo silné podezření, že jsou způsobeny citlivými bakteriemi. Pokud jsou k dispozici informace o kultivaci a citlivosti, měly by být tyto informace zohledněny při výběru nebo úpravě antibakteriální léčby. Pokud takové údaje nejsou k dispozici, může k empirické volbě léčby přispět místní epidemiologie a vzorce citlivosti.
DÁVKOVÁNÍ & PODÁVÁNÍ
Dospělí a dětští pacienti ve věku nejméně 15 let
Obvyklá dávka perorálního cefalexinu je 250 mg každých 6 hodin, ale může být podávána dávka 500 mg každých 12 hodin. Léčba se podává po dobu 7 až 14 dnů.
Při závažnějších infekcích mohou být zapotřebí větší dávky perorálního cefalexinu, a to až 4 g denně ve dvou až čtyřech stejně rozdělených dávkách.
Pediatričtí pacienti (starší 1 roku)
Doporučená celková denní dávka perorálního cefalexinu pro pediatrické pacienty je 25 až 50 mg/kg podávaná ve stejně rozdělených dávkách po dobu 7 až 14 dnů. Při léčbě β-hemolytických streptokokových infekcí se doporučuje doba trvání nejméně 10 dní. In severe infections, a total daily dose of 50 to 100 mg/kg may be administered in equally divided doses.
For the treatment of otitis media, the recommended daily dose is 75 to 100 mg/kg given in equally divided doses.
| Weight 10 kg (22 lb) 20 kg (44 lb) 40 kg (88 lb) |
Cephalexin Suspension 125mg/5mL ½ to 1 tsp q.i.d. 1 to 2 tsp q.i.d. 2 to 4 tsp q.i.d. |
250mg/5mL ¼ to ½ tsp q.i.d. ½ to 1 tsp q.i.d. 1 to 2 tsp q.i.d. |
| Weight 10 kg (22 lb) 20 kg (44 lb) 40 kg (88 lb) |
125mg/5mL 1 to 2 tsp b.i.d. 2 to 4 tsp b.i.d. 4 to 8 tsp b.i.d. |
250mg/5mL ½ to 1 tsp b.i.d 1 to 2 tsp b.i.d. 2 to 4 tsp b.i.d. |
Pokyny pro míchání
125 mg na 5 ml (100 ml po smíchání): Doba přípravy suspenze při dávkování. Přidejte do lahvičky celkem 67 ml vody. Pro usnadnění přípravy poklepejte na láhev, aby se prášek uvolnil, přidejte vodu ve 2 dávkách a po každém přidání dobře protřepejte. Výsledná suspenze bude obsahovat monohydrát cefalexinu odpovídající 125 mg cefalexinu v každých 5 ml (čajová lžička).
125 mg na 5 ml (200 ml po smíchání): Doba přípravy suspenze při dávkování. Přidejte do lahvičky celkem 134 ml vody. Pro usnadnění přípravy poklepejte na lahvičku, aby se prášek uvolnil, přidejte vodu ve 2 dávkách a po každém přidání dobře protřepejte. Výsledná suspenze bude obsahovat monohydrát cefalexinu odpovídající 125 mg cefalexinu v každých 5 ml (čajová lžička).
250 mg na 5 ml (100 ml po smíchání): Doba přípravy suspenze při dávkování. Přidejte do lahvičky celkem 67 ml vody. Pro usnadnění přípravy poklepejte na lahvičku, aby se prášek uvolnil, přidejte vodu ve 2 dávkách a po každém přidání dobře protřepejte. Výsledná suspenze bude obsahovat monohydrát cefalexinu odpovídající 250 mg cefalexinu v každých 5 ml (čajová lžička).
250 mg na 5 ml (200 ml po smíchání): Doba přípravy suspenze při dávkování. Přidejte do lahvičky celkem 134 ml vody. Pro usnadnění přípravy poklepejte na láhev, aby se prášek uvolnil, přidejte vodu ve 2 dávkách a po každém přidání dobře protřepejte. Výsledná suspenze bude obsahovat monohydrát cefalexinu odpovídající 250 mg cefalexinu v každých 5 ml (čajová lžička).
*Po smíchání uchovávejte v chladničce. Lze uchovávat po dobu 14 dnů bez výrazné ztráty účinnosti.
Úpravy dávkování u dospělých a dětských pacientů ve věku nejméně 15 let s poruchou funkce ledvin
Pacientům s poruchou funkce ledvin podávejte cefalexin podle následujících dávkovacích schémat .
Tabulka 1. Recommended Dose Regimen for Patients with Renal Impairment
| Renal function | Dose regimen recommendation |
| Creatinine clearance ≥60 mL/min | No dose adjustment |
| Creatinine clearance 30 to 59 mL/min | No dose adjustment; maximum daily dose should not exceed 1 g |
| Creatinine clearance 15 to 29 mL/min | 250 mg, every 8 hours or every 12 hours |
| Creatinine clearance 5 to 14 mL/min not yet on dialysis* | 250 mg, every 24 hours |
| Creatinine clearance 1 to 4 mL/min not yet on dialysis* | 250 mg, každých 48 hodin nebo každých 60 hodin |
*Pro doporučení úpravy dávky u pacientů na hemodialýze není dostatek informací.
DÁVKOVACÍ FORMY & SILY
Cephalexin pro perorální suspenzi USP
125 mg/5 ml a 250 mg/5 ml
Kontraindikace
.
Cephalexin je kontraindikován u pacientů se známou přecitlivělostí na cephalexin nebo jiné členy skupiny cefalosporinových antibakteriálních léčiv.
Upozornění a opatření
Reakce z přecitlivělosti
Při použití cefalexinu byly hlášeny alergické reakce v podobě vyrážky, kopřivky, angioedému, anafylaxe, multiformního erytému, Stevens-Johnsonova syndromu nebo toxické epidermální nekrolýzy. Před zahájením léčby cefalexinem se informujte, zda se u pacienta v minulosti nevyskytly reakce přecitlivělosti na cefalexin, cefalosporiny, peniciliny nebo jiné léky. Zkřížená přecitlivělost mezi beta-laktamovými antibakteriálními léčivy se může vyskytnout až u 10 % pacientů s alergií na penicilin v anamnéze.
Pokud se objeví alergická reakce na cefalexin, přerušte podávání léku a nasaďte vhodnou léčbu.
Průjmy spojené s Clostridium difficile
Průjmy spojené s Clostridium difficile (CDAD) byly hlášeny při užívání téměř všech antibakteriálních přípravků, včetně cefalexinu, a mohou mít různou závažnost od mírného průjmu až po fatální kolitidu. Léčba antibakteriálními přípravky mění normální flóru tlustého střeva, což vede k přemnožení C. difficile.
C. difficile produkuje toxiny A a B, které přispívají k rozvoji CDAD. Kmeny C. difficile produkující hypertoxin způsobují zvýšenou morbiditu a mortalitu, protože tyto infekce mohou být refrakterní na antimikrobiální léčbu a mohou vyžadovat kolektomii. Na CDAD je třeba myslet u všech pacientů, u kterých se po užívání antibiotik objeví průjem. Je třeba pečlivě odebrat anamnézu, protože bylo hlášeno, že CDAD se objevuje i více než dva měsíce po podání antibakteriálních látek.
Pokud je podezření na CDAD nebo je potvrzeno, může být nutné přerušit pokračující užívání antibiotik, která nejsou zaměřena proti C. difficile. Podle klinické indikace by měl být zahájen vhodný management tekutin a elektrolytů, doplňování bílkovin, antibiotická léčba C. difficile a chirurgické vyšetření.
Přímá sérokonverze Coombsova testu
Při léčbě cefalosporinovými antibakteriálními léčivy včetně cefalexinu byly hlášeny pozitivní přímé Coombsovy testy. Byla hlášena akutní intravaskulární hemolýza vyvolaná léčbou cefalexinem. Pokud se během léčby cefalexinem nebo po ní objeví anémie, proveďte diagnostické vyšetření na léky indukovanou hemolytickou anémii, přerušte podávání cefalexinu a nasaďte vhodnou léčbu.
Potenciál záchvatů
Několik cefalosporinů se podílelo na vyvolání záchvatů, zejména u pacientů s poruchou funkce ledvin, pokud nebyla snížena dávka. Pokud se záchvaty objeví, přerušte podávání cefalexinu. Pokud je to klinicky indikováno, lze podat antikonvulzivní léčbu.
Prodloužený protrombinový čas
Cefalosporiny mohou být spojeny s prodlouženým protrombinovým časem. Mezi rizikové osoby patří pacienti s poruchou funkce ledvin nebo jater nebo se špatným stavem výživy, dále pacienti, kteří dostávají protrahovanou antibakteriální léčbu, a pacienti, kteří dostávají antikoagulační léčbu. U rizikových pacientů sledujte protrombinový čas a postupujte podle indikací.
Vývoj bakterií rezistentních na léky
Předepisování cefalexinu při absenci prokázané nebo silně suspektní bakteriální infekce pravděpodobně nepřinese pacientovi prospěch a zvyšuje riziko vzniku bakterií rezistentních na léky.
Dlouhodobé užívání cefalexinu může vést k přemnožení necitlivých organismů. Pečlivé pozorování pacienta je nezbytné. Pokud během léčby dojde k superinfekci, je třeba přijmout vhodná opatření.
Nežádoucí účinky
Následující závažné příhody jsou podrobněji popsány v části Upozornění a opatření:
– Reakce z přecitlivělosti
– Průjem spojený s Clostridium difficile
– Sérokonverze v přímém Coombsově testu
– Možnost záchvatů
– Vliv na aktivitu protrombinu
– Vývoj bakterií rezistentních vůči léku
Zkušenosti z klinických studií
Protože klinické studie probíhají za velmi rozdílných podmínek, nelze výskyt nežádoucích účinků pozorovaných v klinických studiích určitého léčiva přímo srovnávat s výskytem v klinických studiích jiného léčiva a nemusí odrážet výskyt pozorovaný v praxi.
V klinických studiích byl nejčastějším nežádoucím účinkem průjem. Vyskytly se také nevolnost a zvracení, dyspepsie, gastritida a bolest břicha. Stejně jako u penicilínů a jiných cefalosporinů byla hlášena přechodná hepatitida a cholestatická žloutenka.
Další reakce zahrnovaly reakce z přecitlivělosti, genitální a anální pruritus, genitální kandidózu, vaginitidu a vaginální výtok, závratě, únavu, bolesti hlavy, agitovanost, zmatenost, halucinace, artralgie, artritidu a kloubní poruchy. Byla hlášena reverzibilní intersticiální nefritida. Byla hlášena eozinofilie, neutropenie, trombocytopenie, hemolytická anémie a mírné zvýšení aspartáttransaminázy (AST) a alanin-transaminázy (ALT).
Kromě výše uvedených nežádoucích účinků, které byly pozorovány u pacientů léčených cefalexinem, byly u antibakteriálních léčiv ze skupiny cefalosporinů hlášeny následující nežádoucí účinky a další změny laboratorních testů:
Jiné nežádoucí účinky: Horečka, kolitida, aplastická anémie, krvácení, renální dysfunkce a toxická nefropatie.
Změněné laboratorní testy: Prodloužený protrombinový čas, zvýšený dusík močoviny v krvi (BUN), zvýšený kreatinin, zvýšená alkalická fosfatáza, zvýšený bilirubin, zvýšená laktátdehydrogenáza (LDH), pancytopenie, leukopenie a agranulocytóza.
Lékové interakce
Metformin
Podávání cefalexinu s metforminem vede ke zvýšení plazmatických koncentrací metforminu a snížení renální clearance metforminu.
U pacientů užívajících současně cefalexin a metformin se doporučuje pečlivé sledování pacienta a úprava dávky metforminu .
Probenecid
Vylučování cefalexinu ledvinami je inhibováno probenecidem. Současné podávání probenecidu s cefalexinem se nedoporučuje.
Interakce s laboratorními nebo diagnostickými testy
Při testování přítomnosti glukózy v moči pomocí Benediktova nebo Fehlingova roztoku může dojít k falešně pozitivní reakci.
Použití u specifických populací
Těhotenství
Těhotenství kategorie B
Neexistují žádné adekvátní a dobře kontrolované studie u těhotných žen. Protože reprodukční studie na zvířatech nejsou vždy prediktivní pro reakci u lidí, měl by být tento léčivý přípravek používán během těhotenství pouze v případě jasné potřeby.
Reprodukční studie byly provedeny na myších a potkanech s použitím perorálních dávek monohydrátu cefalexinu 0.6 a 1,5násobku maximální denní dávky pro člověka (66 mg/kg/den) na základě tělesného povrchu a neodhalily žádné známky zhoršené plodnosti nebo poškození plodu.
Kojící matky
Cephalexin se vylučuje do lidského mléka. Při podávání cefalexinu kojícím ženám je třeba dbát zvýšené opatrnosti.
Pediatrické použití
Bezpečnost a účinnost cefalexinu u pediatrických pacientů byla stanovena v klinických studiích pro dávky popsané v bodě Dávkování a způsob podání .
Geriatrické použití
Z 701 subjektů ve 3 publikovaných klinických studiích cefalexinu bylo 433 (62 %) starších 65 let. Mezi těmito subjekty a mladšími subjekty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti a ani další hlášené klinické zkušenosti nezjistily rozdíly v reakcích mezi staršími a mladšími pacienty.
Tento léčivý přípravek je z podstatné části vylučován ledvinami a riziko toxických reakcí na tento léčivý přípravek může být vyšší u pacientů s poruchou funkce ledvin. Vzhledem k tomu, že u starších pacientů je vyšší pravděpodobnost snížené funkce ledvin, je třeba věnovat pozornost volbě dávky .
Poškození funkce ledvin
Cephalexin by měl být podáván s opatrností v případě zhoršené funkce ledvin (clearance kreatininu < 30 ml/min, s dialýzou nebo bez ní). Za těchto podmínek by mělo být prováděno pečlivé klinické pozorování a laboratorní studie monitorující funkci ledvin, protože bezpečné dávkování může být nižší než obvykle doporučované .
Předávkování
Příznaky perorálního předávkování mohou zahrnovat nevolnost, zvracení, epigastrické potíže, průjem a hematurii. V případě předávkování zaveďte obecná podpůrná opatření.
Nebylo zjištěno, že by při předávkování cefalexinem byla prospěšná forsírovaná diuréza, peritoneální dialýza, hemodialýza nebo hemoperfuze dřevěným uhlím.
Popis přípravku Cefalexin suspenze
Cefalexin perorální suspenze, USP je polosyntetické cefalosporinové antibakteriální léčivo určené k perorálnímu podání. Jedná se o monohydrát kyseliny 7-(D-α-amino-α-fenylacetamido)-3-methyl-3-cephem-4-karboxylové. Cephalexin má molekulový vzorec C16H17N3O4S-H2O a molekulová hmotnost je 365,41.
Cephalexin má následující strukturní vzorec:
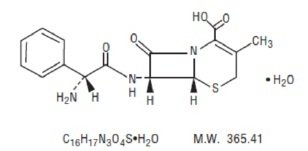
Inactive Ingredients: Koloidní oxid křemičitý, FD&Cervená # 40, methylcelulosa (15 premium LV), methylcelulosa (4AC premium), natrium-benzoát, jahodové aroma, sacharosa, xanthanová guma.
Cephalexin suspenze – klinická farmakologie
Mechanismus účinku
Cephalexin je cefalosporinové antibakteriální léčivo .
Farmakokinetika
Absorpce:
Cephalexin je kyselostabilní a může být podáván bez ohledu na jídlo. Po podání dávek 250 mg, 500 mg a 1 g bylo dosaženo průměrných maximálních sérových hladin přibližně 9, 18 a 32 mcg/ml za 1 hodinu. Sérové hladiny byly detekovatelné 6 hodin po podání (na úrovni detekce 0,2 mcg/ml).
Distribuce:
Cephalexin je přibližně z 10 až 15 % vázán na plazmatické bílkoviny.
Vylučování:
Cephalexin se vylučuje močí glomerulární filtrací a tubulární sekrecí. Studie ukázaly, že více než 90 % léčiva se vyloučí v nezměněné formě močí během 8 hodin. Během této doby byly maximální koncentrace v moči po podání dávek 250 mg, 500 mg a 1 g přibližně 1 000, 2 200 a 5 000 mcg/ml.
Lékové interakce:
U zdravých osob, kterým byly podány jednotlivé 500 mg dávky cefalexinu a metforminu, se průměrná plazmatická Cmax a AUC metforminu zvýšily v průměru o 34 %, resp. 24 % a průměrná renální clearance metforminu se snížila o 14 %. Nejsou k dispozici žádné informace o interakci cefalexinu a metforminu po podání více dávek obou léčivých látek.
Mikrobiologie
Mechanismus účinku
Cefalexin je baktericidní látka, která působí inhibicí syntézy bakteriální buněčné stěny.
Rezistence
Meticilin-rezistentní stafylokoky a většina izolátů enterokoků jsou vůči cefalexinu rezistentní. Cefalexin není účinný proti většině izolátů Enterobacter spp, Morganella morganii a Proteus vulgaris. Cefalexin nepůsobí proti Pseudomonas spp. a Acinetobacter calcoaceticus. Streptococcus pneumoniae rezistentní vůči penicilinu je obvykle zkříženě rezistentní vůči beta-laktamovým antibakteriálním léčivům.
Antimikrobiální aktivita
Bylo prokázáno, že cefalexin je účinný proti většině izolátů následujících bakterií jak in vitro, tak při klinických infekcích .
Gram-pozitivní bakterie
Staphylococcus aureus (pouze izoláty citlivé na meticilin) Streptococcus pneumoniae (izoláty citlivé na penicilin) Streptococcus pyogenes
Gram-pozitivní bakterie
Staphylococcus aureus (pouze izoláty citlivé na methicilin)negativní bakterie Escherichia coli Haemophilus influenzae Klebsiella pneumoniae Moraxella catarrhalis Proteus mirabilis
Testování citlivosti
Specifické informace týkající se interpretačních kritérií testů citlivosti a souvisejících testovacích metod a standardů kontroly kvality uznaných FDA pro tento léčivý přípravek, viz: https://www.fda.gov/STIC.
Nonclinical Toxicology
Carcinogenesis & Mutagenesis & Impairment Of Fertility
Lifetime studies in animals have not been performed to evaluate the carcinogenic potential of cephalexin. Tests to determine the mutagenic potential of cephalexin have not been performed. In male and female rats, fertility and reproductive performance were not affected by cephalexin oral doses up to 1.5 times the highest recommended human dose based upon body surface area.
How Supplied/Storage and Handling
Cephalexin for oral suspension* USP (a strawberry flavored formula) is supplied as follows:
125 mg/5 mL:
Bottles of 100 mL (NDC 67877-544-88)
Bottles of 200 mL (NDC 67877-544-68)
250 mg/5 mL:
Bottles of 100 mL (NDC 67877-545-88)
Bottles of 200 mL (NDC 67877-545-68)
Directions for mixing are included on the label.
Skladujte při teplotě 20o až 25o C (68o až 77o F) .
Před použitím dobře protřepejte. Uchovávejte těsně uzavřené.
*Po smíchání skladujte v chladničce. Lze uchovávat po dobu 14 dnů bez výrazné ztráty účinnosti.
Informace pro pacienty
- Upozorněte pacienty, že se mohou vyskytnout alergické reakce, včetně závažných alergických reakcí, a že závažné reakce vyžadují okamžitou léčbu. Zeptejte se pacienta na případné předchozí reakce přecitlivělosti na cefalexin, jiné beta-laktamy (včetně cefalosporinů) nebo jiné alergeny (5.1)
- Poradit pacientům, že průjem je běžný problém způsobený antibakteriálními léčivy a obvykle odezní po vysazení léku. Někdy se může objevit častý vodnatý nebo krvavý průjem, který může být známkou závažnější střevní infekce. Pokud se objeví závažný vodnatý nebo krvavý průjem, doporučte pacientům, aby kontaktovali svého lékaře.
- Poradit pacientům, že antibakteriální léky, včetně cefalexinu, by měly být používány pouze k léčbě bakteriálních infekcí. Neléčí virové infekce (např. nachlazení). Pokud je cefalexin předepsán k léčbě bakteriální infekce, informujte pacienty, že ačkoli je běžné, že se na počátku léčby cítí lépe, lék je třeba užívat přesně podle pokynů. Vynechání dávek nebo nedokončení celé léčby může (1) snížit účinnost okamžité léčby a (2) zvýšit pravděpodobnost, že si bakterie vytvoří rezistenci a v budoucnu nebudou léčitelné cefalexinem nebo jinými antibakteriálními léky.
Vyrobeno v Indii:
Alkem Laboratories Ltd.,
Mumbai – 400013, INDIE.
Distribuuje:
Ascend Laboratories, LLC
Parsippany, NJ 07054
Revidováno:
NDC 67877-544-88
Cephalexin pro perorální suspenzi, USP 125 mg v 5 ml
po rekonstituci podle návodu.
Obvyklá pediatrická dávka: 25 až 50 mg na kg denně ve čtyřech rozdělených dávkách. Při závažnější infekci může být dávka zdvojnásobena. Viz průvodní literatura.
Pouze pro perorální použití
100 ml (po smíchání)
Ascend Laboratories, LLC

NDC 67877-545-88
Cephalexin pro perorální suspenzi, USP 250 mg na 5 ml
po rekonstituci podle návodu.
Obvyklá pediatrická dávka: 25 až 50 mg na kg denně ve čtyřech rozdělených dávkách. Při těžší infekci může být dávka zdvojnásobena.
Viz doprovodná literatura.
Pouze na lékařský předpis
Pouze k perorálnímu použití
100 ml (po smíchání)
Laboratoře Ascend, LLC

| CEPHALEXIN cephalexin pro suspenzi |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| CEPHALEXIN cephalexin for suspension |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Ascend Laboratories, LLC (141250469)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Alkem Laboratories Limited | 915628612 | MANUFACTURE(67877-544, 67877-545) | |
Frequently asked questions
- What are the best antibiotics for a tooth infection?
- Cephalexin – can this be used to treat an abscess in the mouth or gum infection?
- If people are allergic to amoxicillin can they take cephalexin?
- What is the best antibiotic to treat strep throat?
- Can you take cephalexin for a spider bite?
- Can you take antibiotics while pregnant?
- Cephalexin – is this a drug that can be abused by teens?
More about cephalexin
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Patient Tips
- Drug Images
- Drug Interactions
- Compare Alternatives
- Support Group
- Pricing & Coupons
- En Español
- 415 Reviews
- Drug class: first generation cephalosporins
Consumer resources
- Patient Information
- Cephalexin (Advanced Reading)
Professional resources
- Prescribing Information
- Cephalexin (Professional Patient Advice)
- Cephalexin (FDA)
- Cephalexin Tablets (FDA)
Other brands Keflex, Daxbia, Panixine
Related treatment guides
- Bacterial Infection
- Bladder Infection
- Bacterial Endocarditis Prevention
- Acne
- … +7 more
Medical Disclaimer