Úvod
Iontová vazba je úplný přenos valenčních elektronů mezi atomy. Jedná se o typ chemické vazby, při níž vznikají dva opačně nabité ionty. V iontové vazbě kov ztrácí elektrony a stává se kladně nabitým kationtem, zatímco nekov tyto elektrony přijímá a stává se záporně nabitým aniontem. Iontová vazba vyžaduje donor elektronů, často kov, a akceptor elektronů, nekov.
Iontová vazba je pozorována proto, že kovy mají na svých nejvzdálenějších orbitalech málo elektronů. Ztrátou těchto elektronů mohou tyto kovy dosáhnout konfigurace vzácného plynu a splnit oktetové pravidlo. Podobně nekovy, které mají ve svých valenčních slupkách téměř 8 elektronů, mají tendenci snadno přijímat elektrony a dosáhnout konfigurace vzácných plynů. V iontové vazbě lze odevzdat nebo přijmout více než 1 elektron, aby bylo splněno pravidlo oktetu. Náboje aniontu a kationtu odpovídají počtu odevzdaných nebo přijatých elektronů. V iontové vazbě musí být čistý náboj sloučeniny nulový.
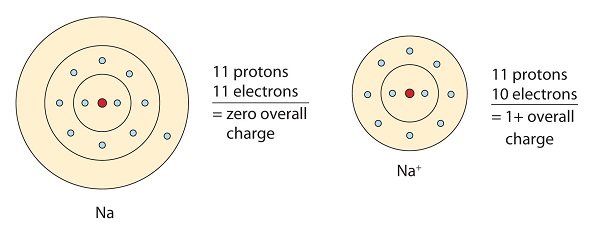
Tato molekula sodíku daruje osamělý elektron ve svém valenčním orbitalu, aby dosáhla oktetové konfigurace. Díky ztrátě elektronu tak vznikne kladně nabitý kationt.
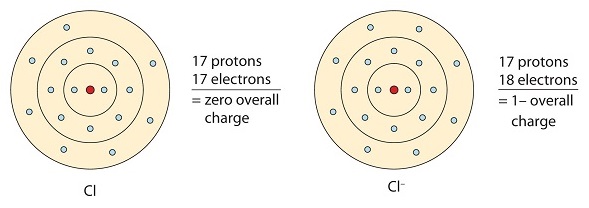
Tento atom chloru přijme jeden elektron, aby dosáhl oktetové konfigurace, čímž vznikne záporně nabitý aniont.
Předpokládaná celková energie procesu iontové vazby, která zahrnuje ionizační energii kovu a elektronovou afinitu nekovu, je obvykle kladná, což znamená, že reakce je endotermická a nepříznivá. Tato reakce je však velmi příznivá díky elektrostatické přitažlivosti mezi částicemi. Při ideální meziatomové vzdálenosti uvolňuje přitažlivost mezi těmito částicemi dostatek energie k usnadnění reakce. Většina iontových sloučenin má tendenci disociovat v polárních rozpouštědlech, protože jsou často polární. Tento jev je způsoben opačnými náboji na každém iontu.
Příklad \(\PageIndex{1}\): Chloridové soli
.jpg?revision=2)
V tomto příkladu atom sodíku daruje svůj 1 valenční elektron atomu chloru. Vzniká tak sodný kationt a chlorový aniont. Všimněte si, že čistý náboj výsledné sloučeniny je 0.
.jpg?revision=2)
V tomto příkladu atom hořčíku odevzdává oba své valenční elektrony atomům chloru. Každý atom chloru může přijmout pouze 1 elektron, aby mohl dosáhnout konfigurace vzácného plynu; proto jsou k přijetí 2 elektronů darovaných hořčíkem zapotřebí 2 atomy chloru. Notice that the net charge of the compound is 0.