Reference >> Návod na návrh primerů pro PCR
Návod na návrh primerů pro PCR
PCR (polymerázová řetězová reakce)
Polymerázová řetězová reakce je obecně považována za jeden z nejdůležitějších vynálezů 20. století v molekulární biologii. Malá množství genetického materiálu lze nyní amplifikovat, aby bylo možné identifikovat, manipulovat s DNA, detekovat infekční organismy, včetně virů, které způsobují AIDS, hepatitidu, tuberkulózu, detekovat genetické odchylky, včetně mutací, v lidských genech a mnoho dalších úkolů.
PCR zahrnuje následující tři kroky: Denaturace, žíhání a prodlužování. Nejprve se genetický materiál denaturuje, čímž se dvouřetězcové molekuly DNA přemění na jednořetězcové. Poté se primery žíhají na komplementární oblasti jednovláknových molekul. Ve třetím kroku se působením DNA polymerázy prodlouží. Všechny tyto kroky jsou citlivé na teplotu a běžně se volí teploty 94oC, 60oC a 70oC. Pro úspěšné reakce je nezbytný dobrý návrh primerů. Důležité úvahy o návrhu popsané níže jsou klíčem ke specifické amplifikaci s vysokou výtěžností. Uvedené preferované hodnoty jsou standardně zabudovány do všech našich produktů.
1. Délka primeru: Obecně se uznává, že optimální délka primerů PCR je 18-22 bp. Tato délka je dostatečně dlouhá pro dostatečnou specifičnost a dostatečně krátká, aby se primery snadno vázaly na templát při teplotě žíhání.
2. Teplota tání primeru: Teplota tání primeru (Tm) je podle definice teplota, při které jedna polovina duplexu DNA disociuje a stane se jednovláknovou, a udává stabilitu duplexu. Primery s teplotou tání v rozmezí 52-58 oC obecně poskytují nejlepší výsledky. Primery s teplotou tání nad 65 oC mají tendenci k sekundárnímu žíhání. Obsah GC v sekvenci poskytuje dostatečnou indikaci Tm primeru. Všechny naše produkty ji vypočítávají pomocí termodynamické teorie nejbližšího souseda, která je považována za mnohem lepší metodu jejího odhadu a která je považována za nejnovější a nejlepší dostupnou.
Formule pro výpočet Tm primeru:
Teplota tání Tm(K)={ΔH/ ΔS + R ln(C)}, nebo Teplota tání Tm(oC) = {ΔH/ ΔS + R ln(C)} – 273,15 kde
ΔH (kcal/mole) : H je entalpie. Entalpie je množství tepelné energie, kterou mají látky. ΔH je změna entalpie. Ve výše uvedeném vzorci se ΔH získá sečtením hodnot entalpie všech di-nukleotidových párů každého nejbližšího sousedního páru bází.
ΔS (kcal/mol) : S je míra neuspořádanosti, kterou systém vykazuje, se nazývá entropie. ΔS je změna entropie. Zde se získá sečtením všech hodnot entropie di-nukleotidových párů každého nejbližšího sousedního páru bází. Je přidána dodatečná korekce na soli, protože parametry nejbližšího souseda byly získány ze studií tání DNA provedených v 1M Na+ pufru a to je výchozí podmínka použitá pro všechny výpočty.
ΔS (korekce na soli) = ΔS (1M NaCl )+ 0.368 x N x ln()
Kde
N je počet párů nukleotidů v primeru ( délka primeru -1).
je ekvivalent soli v mM.
výpočet:
= koncentrace monovalentních iontů +4 x volný Mg2+.
3. Teplota žíhání primeru: Teplota tání primeru je odhadem stability hybridu DNA-DNA a je rozhodující pro určení teploty žíhání. Příliš vysoká Ta způsobí nedostatečnou hybridizaci primer-šablona, což má za následek nízký výtěžek produktu PCR. Příliš nízká Ta může případně vést k nespecifickým produktům způsobeným vysokým počtem neshodných párů bází. Bylo zjištěno, že tolerance neshod má nejsilnější vliv na specifičnost PCR.
Ta = 0,3 x Tm(primer) + 0,7 Tm (produkt) – 14.9
kde,
Tm(primer) = teplota tání primerů
Tm(produkt) = teplota tání produktu
4. Obsah GC: Obsah GC (počet G a C v primeru v procentech z celkového počtu bází) primeru by měl být 40-60 %.
5. GC svorka: Přítomnost bází G nebo C v posledních pěti bázích od 3′ konce primerů (GC clamp) pomáhá podpořit specifickou vazbu na 3′ konci díky silnější vazbě bází G a C. V posledních pěti bázích na 3′ konci primeru by nemělo být více než 3 G nebo C.
6. Sekundární struktury primeru: Přítomnost sekundárních struktur primeru vzniklých intermolekulárními nebo intramolekulárními interakcemi může vést ke špatné nebo žádné výtěžnosti produktu. Nepříznivě ovlivňují žíhání templátu primeru, a tím i amplifikaci. Výrazně snižují dostupnost primerů pro reakci.
i) Vlásenky: Vznikají intramolekulární interakcí uvnitř primeru a je třeba se jim vyhnout. Optimálně se obecně toleruje vlásenka na 3′ konci s ΔG -2 kcal/mol a vnitřní vlásenka s ΔG -3 kcal/mol.
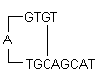
DefiniceΔG: Gibbsova volná energie G je mírou množství práce, kterou lze získat z procesu probíhajícího za konstantního tlaku. Je to míra spontánnosti reakce. Stabilita vlásenky je běžně reprezentována její hodnotou ΔG, tedy energií potřebnou k rozbití sekundární struktury. Větší záporná hodnota ΔG označuje stabilní, nežádoucí vlásenky. Přítomnost vlásenek na 3′ konci ovlivňuje reakci nejnepříznivěji.
ΔG = ΔH – TΔS
ii) Self-dimer: Self-dimer primeru vzniká mezimolekulární interakcí mezi dvěma primery (stejného smyslu), přičemž primer je homologní sám sobě. Obecně se při PCR používá velké množství primerů v porovnání s množstvím cílového genu. Když primery tvoří mezimolekulární dimery mnohem snadněji než hybridizují s cílovou DNA, snižují výtěžnost produktu. Optimálně se obecně toleruje vlastní dimer na 3′ konci s ΔG -5 kcal/mol a vnitřní vlastní dimer s ΔG -6 kcal/mol.
iii) Křížový dimer: Křížové dimery primerů vznikají mezimolekulární interakcí mezi sense a antisense primery, pokud jsou homologní. Optimálně je obecně tolerován křížový dimer na 3′ konci s ΔG -5 kcal/mol a vnitřní křížový dimer s ΔG -6 kcal/mol.
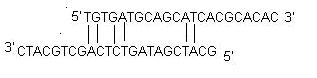
7. Opakování: Opakování je di-nukleotid vyskytující se mnohokrát po sobě a je třeba se mu vyhnout, protože se může chybně primitivizovat. Např: ATATATATAT. Maximální počet přijatelných di-nukleotidových opakování v oligu jsou 4 di-nukleotidy.
8. Běhy: Primérům s dlouhými běhy jedné báze je třeba se obecně vyhnout, protože mohou chybovat. Například AGCGGGGGGGATGGGG má běhy báze „G“ o hodnotě 5 a 4. Maximální počet akceptovaných běhů je 4bp.
9. Stabilita na konci 3′: Je to maximální hodnota ΔG pěti bází z 3′ konce. Nestabilní 3′ konec (méně záporná hodnota ΔG) bude mít za následek méně falešných primingů.
10. Vyhněte se sekundární struktuře šablony: Jednovláknové sekvence nukleových kyselin jsou vysoce nestabilní a skládají se do konformací (sekundárních struktur). Stabilita těchto sekundárních struktur templátu závisí do značné míry na jejich volné energii a teplotě tání(Tm). Zohlednění sekundárních struktur templátu je důležité při navrhování primerů, zejména při qPCR. Pokud jsou primery navrženy na sekundárních strukturách, které jsou stabilní i nad teplotami žíhání, nejsou primery schopny se navázat na templát a výtěžnost produktu PCR je výrazně ovlivněna. Proto je důležité navrhovat primery v oblastech templátů, které během reakce PCR nevytvářejí stabilní sekundární struktury. Naše produkty určují sekundární struktury templátu a navrhují primery, které se jim vyhýbají.
11. Jaké jsou sekundární struktury templátu? Vyhněte se křížové homologii: Pro zlepšení specifičnosti primerů je nutné vyhnout se oblastem homologie. Primery navržené pro určitou sekvenci nesmí amplifikovat jiné geny ve směsi. Běžně se navrhují primery a poté se testuje specifičnost metodou BLAST. Naše produkty nabízejí lepší alternativu. Při navrhování primerů se můžete vyhnout oblastem křížové homologie. Templáty můžete porovnat s příslušnou neredundantní databází BLAST a software interpretuje výsledky. Identifikuje oblasti významných křížových homologií v každé šabloně a vyhne se jim při vyhledávání primerů.
Parametry pro návrh párů primerů
1. V případě, že se jedná o křížové homologie, je třeba provést jejich analýzu. Délka amplikonu: Délka amplikonu je dána cíli experimentu. U qPCR se cílová délka blíží 100 bp a u standardní PCR se blíží 500 bp. Pokud znáte pozice jednotlivých primerů vzhledem k templátu, vypočítá se produkt takto: Délka produktu = (pozice antisense primeru – pozice sense primeru) + 1.
2. Pozice produktu: Primer může být umístěn u 5′ konce, 3′ konce nebo kdekoli v rámci stanovené délky. Obecně platí, že sekvence v blízkosti 3′ konce je známa s větší jistotou, a proto se jí dává přednost nejčastěji.
3. Tm produktu: Teplota tání (Tm) je teplota, při které jedna polovina duplexu DNA disociuje a stane se jednovláknovou. Pomocí teploty tání (Tm) lze měřit stabilitu duplexu primer-templát DNA.
4. Optimální teplota žíhání (Ta Opt): Nejvíce se respektuje Rychlíkův vzorec. Naše produkty tento vzorec používají k výpočtu a tisíce našich zákazníků hlásí dobré výsledky při jeho použití pro žíhací krok cyklu PCR. Obvykle vede k dobrému výtěžku produktů PCR s minimální produkcí falešných produktů.
Ta Opt = 0,3 x(Tm primeru) + 0,7 x(Tm produktu) – 14.9
kde
Tm primeru je teplota tání méně stabilního páru primer-šablona
Tm produktu je teplota tání produktu PCR.
5. Výpočet neshody Tm páru primerů: Dva primery z páru primerů by měly mít těsně shodné teploty tání, aby se maximalizoval výtěžek produktu PCR. Rozdíl 5oC nebo více může vést k tomu, že nedojde k amplifikaci.
Návrh primerů pomocí softwaru
K dispozici je řada nástrojů pro návrh primerů, které mohou pomoci při návrhu primerů PCR jak novým, tak zkušeným uživatelům. Tyto nástroje mohou snížit náklady a čas spojené s experimentováním tím, že sníží pravděpodobnost neúspěšného experimentu.
Primer Premier se řídí všemi pokyny uvedenými pro návrh primerů PCR. Primer Premier lze použít k návrhu primerů pro jednotlivé templáty, zarovnání, návrh degenerovaných primerů, analýzu restrikčních enzymů. analýzu kontigů a návrh sekvenačních primerů.
Pokyny pro návrh primerů qPCR se mírně liší. Software jako AlleleID a Beacon Designer dokáže navrhovat primery a oligonukleotidové sondy pro komplexní detekční testy, jako jsou multiplexní testy, návrh primerů pro křížení druhů, návrh primerů specifických pro jednotlivé druhy a návrh primerů pro snížení nákladů na experimenty.
PrimerPlex je software, který dokáže navrhovat primery pro multiplexní PCR a multiplexní testy genotypování SNP.