1. Přehled signalizace Erk
Dráha extracelulárním signálem regulované kinázy (ERK) je jednou z hlavních signálních kazet signální dráhy mitogenem aktivované proteinkinázy (MAPK). Kaskáda ERK je aktivována různými extracelulárními činiteli, včetně růstových faktorů, hormonů a také buněčných stresů, za účelem indukce buněčných procesů, které zahrnují především proliferaci a diferenciaci, ale za určitých podmínek také stresovou odpověď a další. Hlavními složkami MAPK/ERK kinázy (MEKK) jsou členové rodiny Raf Raf-1, A-Raf a B-Raf, kteří fosforylují dva serinové zbytky na složkách MAPK/ERK kinázy (MEK) MEK1/2. V případě, že se jedná o MEK1/2, dochází k jejich fosforylaci. ERK1/2 jsou zodpovědné za stimulaci následných efektorů, z nichž mnohé jsou transkripční faktory. Jedním z hlavních transkripčních faktorů je protein CREB (cyclic AMP response element-binding protein).
Tato dráha ERK přispívá k řízení velkého množství buněčných procesů:
– regulace buněčné proliferace, jako je aktivace T-buněk
– synaptické plasticity, jako je např. dlouhý čas.dlouhodobá potenciace (LTP) v hipokampálních neuronech
– Proliferace endoteliálních buněk během angiogeneze
– Fosforylace transkripčního faktoru p53
– Remodelace signální dráhy ERK může přispívat k rozvoji polycystického onemocnění ledvin
– Aktivace fosfolipázy A2 (PLA2) v žírných buňkách.
2. Signální kaskáda Erk
Aktivace kaskády ERK1/2 je většinou iniciována na membránových receptorech, jako jsou receptorové Tyr kinázy (RTK), receptory spřažené s G proteiny (GPCR), iontové kanály a další. Tyto receptory přenášejí signál rekrutací adaptorových proteinů (např. Grb2) a výměnných faktorů (např. SOS), které následně vyvolávají aktivaci Ras na plazmatických membránách nebo membránách jiných organel. Aktivovaný, na GTP vázaný Ras pak přenáší signál aktivací proteinkináz Raf-1, B-Raf a A-Raf (Rafs) v rámci úrovně MAP3K této kaskády. K aktivaci dochází rekrutací Rafs na membrány, kde jsou následně fosforylovány a aktivovány. MOS je další MAP3K kaskády ERK, ale působí především v reprodukčním systému odlišným způsobem regulace. Z úrovně MAP3K se pak signál přenáší dolů po kaskádě prostřednictvím složek MAPKK: MEK1/2. Ty jsou aktivovány serinovou fosforylací na typickém motivu Ser-Xaa-Ala-Xaa-Ser/Thr v aktivační smyčce MAPKK. Na druhé straně MEK1/2 aktivují své jediné známé substráty, nativní ERK1/2, které fungují jako jejich jediné následné cíle, což naznačuje, že MEK1/2 slouží jako složky určující specifičnost kaskády ERK1/2. MEK1/2 jsou jediné proteinkinázy s duální specifitou, které mohou fosforylovat jak regulační zbytky Thr, tak Tyr ERK1/2. Dosud bylo identifikováno přibližně 200 různých substrátů ERK1/2. Jedná se o substráty buď v cytosolu (např. PLA2 RSK), nebo po translokaci v jádře, včetně transkripčních faktorů, jako jsou Elk1, c-Fos a c-Jun.
– MAP3K-Raf 1
Raf-1 je nejlépe prostudovanou ze signálních molekul růstových faktorů na úrovni kaskády MAP3K. Jedná se o 70- až 75kDa proteinovou serin/treonin kinázu, která obsahuje kinázovou doménu v COOH-koncové polovině molekuly a regulační doménu zabírající zbytek. Při stimulaci různými mitogeny dochází k přechodné aktivaci Raf-1 během 2 až 3 mm. Mechanismus aktivace Raf-1 byl v posledních několika letech intenzivně studován. Nyní je jasné, že Raf-1 se nachází za HAS, který zřejmě při stimulaci interaguje přímo s NH2-koncovou částí Raf-1.
– MAPKK-MEK1/2
MEK představují evolučně konzervovanou rodinu proteinových serin/treoninových kináz, která doposud zahrnuje tři vysoce homologní (85 %) savčí izoformy. Mechanismus aktivace MEK-1 zahrnuje fosforylaci proteinu pouze na serinových zbytcích a zdá se, že je podobný, ať už je fosforylován MEKK, Raf-1 nebo autofosforylací, jak bylo zjištěno pomocí fosfopeptidových map. MAPKK (MEK) jsou vysoce specifické pro následné složky ERK-1 a ERK-2. MAPKK navíc nerozpoznaly ani denaturovanou formu svého substrátu, ani peptidy obsahující fosforylační místa v ERK, což naznačuje, že enzym vyžaduje nativní formu MAPK.
– MAPK-ERK-1/2
Vzhledem k vysoké míře podobnosti jsou ERK-1 a ERK-2 obvykle považovány za funkčně nadbytečné. Hlavním upstream mechanismem vedoucím k fosforylaci ERK-1 a -2 na obou těchto regulačních zbytcích je jejich fosforylace pomocí MEK. Vzhledem k poměrně širokému charakteru rozpoznávání substrátů mohou ERK po své aktivaci fosforylovat velké množství proteinů. Tyto proteiny mají často regulační charakter a nacházejí se jak v cytoplazmě, tak v jádře.
3. Následná signalizace dráhy Erk
– Buněčná proliferace
Aktivovaný ERK1/2 fosforyluje RSK a RSK i ERK se přemisťují do jádra, kde aktivují řadu transkripčních faktorů, jako jsou CREB, Fos a Elk-1, což v konečném důsledku vede k syntéze efektorových proteinů a způsobuje změny v proliferaci a přežívání buněk. CREB (cAMP response element-binding protein) je buněčný transkripční faktor, který může zvýšit transkripci genu více než 10krát. c-Fos je protein o 380 aminokyselinách se základní oblastí leucinového zipu pro dimerizaci a vazbu na DNA a transaktivační doménou na C-konci. Podílí se na důležitých buněčných dějích, včetně buněčné proliferace, diferenciace a přežití; protein obsahující doménu ETS (Elk-1) je protein, který je u člověka kódován genem ELK1. Funkce Elk-1 je také jako aktivátor transkripce.
– Onkogeneze
AktivaceERK1/2 podporuje metaplazii a rozvoj nádorů tím, že fosforyluje Bim a Bid a způsobuje degradaci Bim proteazomem a sekvestraci Bad do proteinů vázajících fosfoseriny, a tím inhibuje apoptózu. V samostatné cestě aktivace ERK1/2 fosforyluje FOXO3a na Ser 294, Ser 344 a Ser 425 a usnadňuje interakci FOXO3a-MDM2. Tato interakce zvyšuje degradaci FOXO3a prostřednictvím ubikvitin-proteazomové dráhy závislé na MDM2, což vede k rozvoji nádorů.
– Vývoj a diferenciace
Signalizace receptorovými tyrozinkinázami, které aktivují dráhu Ras/Raf/MAP kinázy, reguluje vývoj a diferenciaci mnoha typů buněk. Především prostřednictvím aktivace přenašečů signálu a aktivátorů transkripčních proteinů (STAT).
– Buněčný cyklus
Cdc25 aktivuje cyklin dependentní kinázy odstraněním fosfátu ze zbytků v aktivním místě Cdk. Je známo, že řídí přechody z G1 do S fáze a z G2 do M fáze. Erk1/2 může aktivovat protein Cdc25 a následně podpořit progresi buněčného cyklu.
4. Regulace signalizace Erk
Regulace signalizace Erk je pro nás velmi důležitá pro zachování normální funkce buněk. Existuje více regulačních strategií, kterými buňka reguluje signální dráhu Erk, patří mezi ně především regulace pomocí zpětnovazebních smyček, pomocí lešení vzestupného a sestupného proudu, pomocí fosfatáz a inhibitorů signální dráhy Erk.
– Regulace pomocí zpětnovazebních smyček
V dráze ERK existuje několik bodů negativní zpětné vazby (obr. 1). MEK je jedním z cílů a může být inhibován fosforylací ERK MEK1/2 na Thr292 a Thr212. Fosforylace zabraňuje dalšímu zvyšování aktivity MEK pomocí PAK1, a tím snižuje aktivaci ERK. Fosforylace Rafu na více místech ERK poskytuje druhý možný mechanismus zpětné vazby. Nadměrná fosforylace těchto míst zabraňuje interakci Rafu s GTPázou Ras a podporuje jeho defosforylaci fosfatázou PP2A. Alternativním mechanismem negativní zpětné vazby je aktivace nebo transkripční upregulace fosfatáz ERK. Tyto různé smyčky negativní zpětné vazby aktivované ERK poskytují jeden z prostředků, kterým lze omezit trvání signálu a vrátit dráhu do základního stavu.
– Regulace vzestupným a sestupným proudem lešení
Bílkoviny lešení vážou dvě nebo více složek signální dráhy, aby je přivedly do těsné blízkosti, a tím usnadnily jejich funkční interakci. Kromě toho mohou scaffoldy tyto multienzymové signální moduly zacílit na různá buněčná místa, a tím zvýšit fosforylaci specifické podskupiny substrátů down-stream. Scaffoldy také ovlivňují trvání signálu, zabraňují vzájemnému ovlivňování mezi podobnými drahami a mohou propojit aktivaci signálního modulu se specifickým aktivačním signálem v horním proudu.
– Fosfatázy a inhibitory
Aktivita drah MAPK je určována konkurenčním působením kináz v horním proudu a inhibičních fosfatáz. Dráhy MAPK jsou ukončeny defosforylací jejich složek několika fosfatázami. Bylo prokázáno, že několik serin/treoninových fosfatáz, například PP2A a PP2Ca, a tyrozinových fosfatáz, například PTP-SL a HePTP, inaktivuje MAPK.
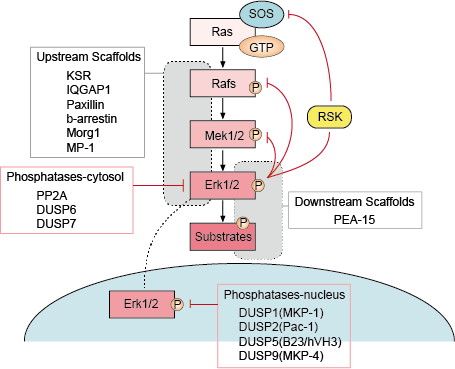
Obr. 1. Regulace signální dráhy Erk
5. Vztah k nemocem
V souladu se svými kritickými rolemi v klíčových buněčných činnostech, včetně buněčné proliferace, diferenciace a přežití nebo smrti, se signální dráhy MAPK podílejí na patogenezi mnoha lidských onemocnění.
– Alzheimerova choroba
Alzheimerova choroba (AD) je neurodegenerativní onemocnění charakterizované poruchami kognitivních funkcí a paměti, o němž se předpokládá, že je důsledkem toho, že se v mozku tvoří jak senilní plaky obsahující amyloid-β (Aβ), tak neurofibrilární spleti obsahující mikrotubulární protein tau. Důkazy tedy naznačují, že signální dráhy MAPK mohou přispívat k patogenezi AD prostřednictvím regulace neuronální apoptózy, aktivity β- a γ-sekretázy a fosforylace APP a tau.
– Parkinsonova choroba
Parkinsonova choroba (PD) je druhé nejrozšířenější neurodegenerativní onemocnění. Různá pozorování naznačují, že signální dráhy MAPK přispívají v patogenezi Parkinsonovy nemoci k neurozánětlivým reakcím a smrti neuronů vyvolané agregáty α-synukleinu nebo funkčními nedostatky parkinu nebo DJ-1.
– Signalizace MAPK u rakoviny
Mnoho mutací složek signálních drah MAPK spojených s rakovinou bylo nalezeno v Ras a B-Raf, které se účastní signální dráhy ERK. Signální dráha ERK hraje roli v několika krocích vývoje nádoru. Fosforylace proteinů, jako je kináza lehkých myozinových řetězců, kalpain, kináza fokální adheze a paxilin, pomocí ERK podporuje migraci nádorových buněk. Signalizace ERK1/2 navíc reguluje aktivity a hladiny proteinů rodiny Bcl-2, jako je proapoptotický protein BIM a anti-apoptotický protein MCL-1, čímž podporuje přežívání nádorových buněk.
| Keshet Y, Seger R. The MAP kinase signaling cascades: a system of hundreds of components regulates a diverse array of physiological functions. MAP Kinase Signaling Protocols: Second Edition, 2010: 3-38. | |
| Wortzel I, Seger R. The ERK cascade distinct functions within various subcellular organelles. Genes & cancer, 2011, 2(3): 195-209. | |
| Ramos J W. The regulation of extracellular signal-regulated kinase (ERK) in mammalian cells. The international journal of biochemistry & cell biology, 2008, 40(12): 2707-2719. | |
| Shaul Y D, Seger R. The MEK/ERK cascade: from signaling specificity to diverse functions. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2007, 1773(8): 1213-1226. | |
| Yao Z, Seger R. The ERK signaling cascade—views from different subcellular compartments. Biofactors, 2009, 35(5): 407-416. |